Hvor mange mol til sølvchlorid produceres fra 7 mol nitrat?
* Vi har brug for den komplette kemiske reaktion. Antallet af mol produceret sølvchlorid afhænger af den specifikke reaktion, der involverer nitrat. For eksempel:
* reaktion 1: Agno₃ (sølvnitrat) + NaCl (natriumchlorid) → AgCl (sølvchlorid) + nano₃ (natriumnitrat)
* reaktion 2: 2 agno₃ (sølvnitrat) + cacl₂ (calciumchlorid) → 2 AgCl (sølvchlorid) + Ca (NO₃) ₂ (calciumnitrat)
* Vi er nødt til at kende den begrænsende reaktant. Mængden af dannet produkt bestemmes af reaktanten, der løber ud først.
Sådan løser du problemet, når du har den komplette reaktion:
1. Balance den kemiske ligning: Sørg for, at antallet af atomer i hvert element er det samme på begge sider af ligningen.
2. Identificer molforholdet: Den afbalancerede ligning viser forholdet mellem mol nitrat og mol af sølvchloridproduceret.
3. Beregn mol af sølvchlorid: Multiplicer molen af nitrat med molforholdet fra trin 2.
Eksempel:
Lad os bruge den første reaktion ovenfor:
Agno₃ + NaCl → Agcl + Nano₃
1. afbalanceret: Ligningen er allerede afbalanceret.
2. molforhold: Forholdet er 1 mol Agno₃ og 1 mol AgCl.
3. Beregn mol AGCL: Hvis du har 7 mol agno₃, producerer du 7 mol AGCl (da forholdet er 1:1).
Angiv den komplette kemiske reaktion, så jeg kan give dig et specifikt svar!
 Varme artikler
Varme artikler
-
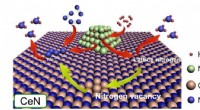 Fyldning af hulrummet i ammoniaksyntese:Nitrogenniveauernes rolle i katalysatorerNikkelpartikler dissocierer H2 for at tilvejebringe H -atomer til enten N -atomer fra selve CeN -krystalgitteret eller fremspringende N -atomer fra N2 -molekyler, der udfylder et nitrogenrum. I dette
Fyldning af hulrummet i ammoniaksyntese:Nitrogenniveauernes rolle i katalysatorerNikkelpartikler dissocierer H2 for at tilvejebringe H -atomer til enten N -atomer fra selve CeN -krystalgitteret eller fremspringende N -atomer fra N2 -molekyler, der udfylder et nitrogenrum. I dette -
 Nye lim klæber nemt, holder godt, og er en gas at trække fra hinandenNicholas Blelloch, Guarini 21, viser en midlertidig lim frem, der er stærk nok til at holde en ph.d.-kandidat, men kan frigives uden magt. Til dette foto, limen blev påført mellem karabinhagerne på to
Nye lim klæber nemt, holder godt, og er en gas at trække fra hinandenNicholas Blelloch, Guarini 21, viser en midlertidig lim frem, der er stærk nok til at holde en ph.d.-kandidat, men kan frigives uden magt. Til dette foto, limen blev påført mellem karabinhagerne på to -
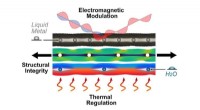 Brug af bioinspireret mikrovaskulatur til at kontrollere materialeegenskaberKredit:North Carolina State University Forskere har skabt og demonstreret et nyt vaskulært metamateriale, der kan omkonfigureres til at ændre dets termiske og elektromagnetiske egenskaber. Vi hen
Brug af bioinspireret mikrovaskulatur til at kontrollere materialeegenskaberKredit:North Carolina State University Forskere har skabt og demonstreret et nyt vaskulært metamateriale, der kan omkonfigureres til at ændre dets termiske og elektromagnetiske egenskaber. Vi hen -
 Flydende støddæmpereKredit:Swiss National Science Foundation Bemærkelsesværdige flydende materialer kaldet kolloider stivner under stød. Forskere finansieret af Swiss National Science Foundation har undersøgt virknin
Flydende støddæmpereKredit:Swiss National Science Foundation Bemærkelsesværdige flydende materialer kaldet kolloider stivner under stød. Forskere finansieret af Swiss National Science Foundation har undersøgt virknin
- Hvad er to måder, hvorpå opløsningsmiddel påvirker solventets egenskaber?
- Hvordan påvirker tilstedeværelsen af magnesium i meteorer deres sammensætning og adfærd, når …
- Hvad gemmer sig bag klappen? Edderkopper, selvfølgelig
- Sådan konverteres centimeter til Square Feet
- Hvad var navnet på blomsterfossiler, som Wegener brugte til IDEA Continental Drift?
- Topologi møder supraledelse gennem innovativ prøveforberedelse i omvendt rækkefølge


