Er sølvchlorid polært eller ionisk ikke -polært?
* Elektronegativitetsforskel: Sølv (Ag) har en elektronegativitet på 1,93, mens klor (CL) har en elektronegativitet på 3,16. Forskellen er ret signifikant (1,23), hvilket indikerer en stærk attraktion mellem de to atomer. Denne forskel fører til dannelse af en ionisk binding, hvor sølv mister et elektron til klor, hvilket resulterer i en positivt ladet sølvion (Ag+) og en negativt ladet chloridion (Cl-).
* krystalstruktur: Sølvchlorid danner en krystallinsk struktur, der holdes sammen af elektrostatiske kræfter mellem de modsatte ladede ioner.
Nøglepunkter:
* ioniske forbindelser: Resultat af overførsel af elektroner mellem atomer, hvilket skaber ioner med modsatte ladninger, der tiltrækkes af hinanden.
* polære forbindelser: Har en signifikant forskel i elektronegativitet mellem atomer, hvilket fører til ujævn deling af elektroner og en delvis positiv og delvis negativ ende inden for molekylet.
* ikke -polære forbindelser: Har en minimal elektronegativitetsforskel, der fører til endda deling af elektroner og ingen signifikant ladningsadskillelse.
Da sølvchlorid udviser en stor elektronegativitetsforskel og danner ioner, klassificeres det som en ionisk forbindelse.
Sidste artikelHvad er et hydroxidsalt?
Næste artikelHvor mange mol til sølvchlorid produceres fra 7 mol nitrat?
 Varme artikler
Varme artikler
-
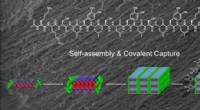 Kemikere udvikler hydrogelstrenge ved hjælp af forbindelse fundet i havdyrRice University kemikere brugte klæbeevnen af en forbindelse fundet i muslinger og forskydningskraft til at hjælpe en nanoskala, multidomæne peptid, set øverst, samles selv til et fiberbundt, der ka
Kemikere udvikler hydrogelstrenge ved hjælp af forbindelse fundet i havdyrRice University kemikere brugte klæbeevnen af en forbindelse fundet i muslinger og forskydningskraft til at hjælpe en nanoskala, multidomæne peptid, set øverst, samles selv til et fiberbundt, der ka -
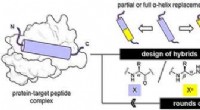 Oligourea foldamerer efterligner peptider alfa-helices og binder effektivt til lægemiddelmålKredit:Wiley Nogle nyttige lægemidler består af peptider, der virker på deres proteinmål. For at gøre dem mere effektive og stabile, forskere har fundet en måde at erstatte afgørende segmenter af
Oligourea foldamerer efterligner peptider alfa-helices og binder effektivt til lægemiddelmålKredit:Wiley Nogle nyttige lægemidler består af peptider, der virker på deres proteinmål. For at gøre dem mere effektive og stabile, forskere har fundet en måde at erstatte afgørende segmenter af -
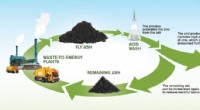 Udvinding af ædle zink fra affaldsaskeEn illustration af processen til genvinding af zink. Kredit:Yen Strandqvist/Chalmers Tekniske Universitet Forbrænding af fast affald producerer årligt millioner af tons affald flyveaske i Europa;
Udvinding af ædle zink fra affaldsaskeEn illustration af processen til genvinding af zink. Kredit:Yen Strandqvist/Chalmers Tekniske Universitet Forbrænding af fast affald producerer årligt millioner af tons affald flyveaske i Europa; -
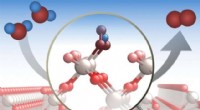 Undersøgelsen afslører detaljer om, hvordan en udbredt katalysator spalter vandIltudviklingsreaktioner er vigtige i en række industrielle processer. En ny undersøgelse giver en detaljeret analyse af processen på molekylært niveau. Som illustreret her, forskerne analyserede, hvor
Undersøgelsen afslører detaljer om, hvordan en udbredt katalysator spalter vandIltudviklingsreaktioner er vigtige i en række industrielle processer. En ny undersøgelse giver en detaljeret analyse af processen på molekylært niveau. Som illustreret her, forskerne analyserede, hvor
- Frigivelse af næringsstoffer fra søbundsedimenter forværrer Lake Eries årlige døde zone
- Røntgenøjne kigger dybere ind i dødbringende patogen
- Guld ændrer fotoluminescens af siliciumkvanteprikker
- Fra superstjerne til mistænkt:Carlos Ghosns skør uge
- Dække over, krympe, dyrke? Økologiske dækafgrødemetoder undersøgt for ukrudtsbekæmpelse
- Eroderer gletsjere bunden af bjerge i bassiner kaldet Cirques?


