Hvad er den nettoioniske ligning til reaktion af kaliumchlorid og bly II -acetat?
1. Skriv den afbalancerede molekylære ligning:
2KCl (aq) + pb (ch₃coo) ₂ (aq) → pbcl₂ (s) + 2kch₃coo (aq)
2. Identificer de opløselige og uopløselige forbindelser:
* opløselig: KCL, PB (CH₃COO) ₂ og kch₃coo (generelt er salte indeholdende alkalimetaller (gruppe 1) og acetationer opløselige).
* uopløselig: PBCL₂ (generelt er halogenider af bly uopløselige).
3. Skriv den komplette ioniske ligning:
2k⁺ (aq) + 2cl⁻ (aq) + pb²⁺ (aq) + 2ch₃coo⁻ (aq) → pbcl₂ (s) + 2k⁺ (aq) + 2ch₃coo⁻ (aq)
4. Annuller tilskuerionerne:
Tilskuerionerne er k⁺ og ch₃coo⁻, fordi de vises på begge sider af ligningen uden at gennemgå nogen ændring.
5. Den nettoioniske ligning er:
Pb²⁺ (aq) + 2cl⁻ (aq) → pbcl₂ (s)
Derfor er den nettoioniske ligning til reaktion af kaliumchlorid og bly (II) acetat Pb²⁺ (aq) + 2Cl⁻ (aq) → pbcl₂ (s).
 Varme artikler
Varme artikler
-
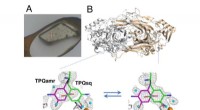 Enzymer ufrosset eventyr:I krystalproteintermodynamikIkke-kryokølet krystal monteret ved hjælp af HAG-metoden (A) og temperaturafhængig ligevægtsændring af katalytiske mellemprodukter i kobberaminoxidase (B). Kredit:Osaka University Enzymer - biokat
Enzymer ufrosset eventyr:I krystalproteintermodynamikIkke-kryokølet krystal monteret ved hjælp af HAG-metoden (A) og temperaturafhængig ligevægtsændring af katalytiske mellemprodukter i kobberaminoxidase (B). Kredit:Osaka University Enzymer - biokat -
 Antistof mod kræftfremkaldende stof dechifreretNår fedt reagerer med glødende kul ved en grill, der dannes et stof, som kemikerne kalder benzopyren. Det er et udbredt miljøgift, der kan forårsage kræft hos mennesker. Kredit:Fotolia/Dederer Som
Antistof mod kræftfremkaldende stof dechifreretNår fedt reagerer med glødende kul ved en grill, der dannes et stof, som kemikerne kalder benzopyren. Det er et udbredt miljøgift, der kan forårsage kræft hos mennesker. Kredit:Fotolia/Dederer Som -
 Bæredygtig separationsteknologi gør nye applikationer muligeKredit:Hollandsk Organisation for Videnskabelig Forskning (NWO) Membraner er meget brugt til at adskille stoffer fra hinanden, fx ved vandbehandling eller nyredialyse. Membranteknologi sparer ener
Bæredygtig separationsteknologi gør nye applikationer muligeKredit:Hollandsk Organisation for Videnskabelig Forskning (NWO) Membraner er meget brugt til at adskille stoffer fra hinanden, fx ved vandbehandling eller nyredialyse. Membranteknologi sparer ener -
 Ny undersøgelse af biofilm kan føre til en mere bæredygtig vandindustriKredit:Pixabay/CC0 Public Domain En lille reduktion af mængden af rester af desinfektionsmiddel, vi bruger til at vedligeholde rent drikkevand, kan give betydelige forbedringer af vandkvaliteten
Ny undersøgelse af biofilm kan føre til en mere bæredygtig vandindustriKredit:Pixabay/CC0 Public Domain En lille reduktion af mængden af rester af desinfektionsmiddel, vi bruger til at vedligeholde rent drikkevand, kan give betydelige forbedringer af vandkvaliteten
- Kvinder er 14 gange mere tilbøjelige til at dø i en klimakatastrofe end mænd - kun én måde, kli…
- Dele af Human Heel
- Hvad er moderselskabets rolle i skabelsen en jord?
- Fysisk aktivitet kan være med til at lukke velstandskløften i skolegang
- Hvad er 2CupseValal hvor mange ounces?
- Hvor kan du se de fleste stjerner?


