Er forbindelser, der altid indeholder metaller, opløselige i vand?
* opløselighed afhænger af mange faktorer: Mens tilstedeværelsen af et metal kan påvirke opløselighed, er det ikke den eneste afgørende faktor. Andre faktorer inkluderer:
* arten af ikke-metalen: Typen af anion (negativt ladet ion) parret med metallet påvirker i høj grad opløselighed. For eksempel er alkalimetalhalogenider (som NaCl) generelt opløselige, mens overgangsmetalhalogenider (som AGCL) ofte er uopløselige.
* Opladningen af metalionen: Højt ladede metalioner har en tendens til at danne mindre opløselige forbindelser.
* størrelsen på metalionen: Større metalioner har en tendens til at være mindre opløselige.
* Tilstedeværelsen af komplekse midler: Visse molekyler kan danne komplekser med metalioner og øge deres opløselighed.
* Eksempler på uopløselige metalforbindelser:
* metaloxider: De fleste metaloxider er uopløselige i vand, såsom jernoxid (Fe2O3) eller aluminiumoxid (Al2O3).
* Metalsulfider: Mange metalsulfider er uopløselige, som kobbersulfid (CUS) eller blysulfid (PBS).
* metalcarbonater: De fleste metalcarbonater er uopløselige, som calciumcarbonat (CACO3) eller magnesiumcarbonat (MGCO3).
Det er vigtigt at huske, at opløselighed er et spektrum, ikke et sort/hvidt problem. Nogle metalforbindelser er meget opløselige, mens andre praktisk talt er uopløselige. Der er også tilfælde, hvor opløselighed påvirkes af temperatur eller pH.
Sidste artikelEr alle fosfatsalte opløselige i vand?
Næste artikelHvordan er natriumchlorid og epsom -salte det samme?
 Varme artikler
Varme artikler
-
 Nye muligheder for lysemitterende plast med mønstret lysMønstret lys i form af en fisk. Kredit:Mattias Lindh Lysemitterende plast bruges i dag i tv- og smartphone-skærme, lysemitterende indikatorer og som belysning til biler og fly med særlige krav. Vi
Nye muligheder for lysemitterende plast med mønstret lysMønstret lys i form af en fisk. Kredit:Mattias Lindh Lysemitterende plast bruges i dag i tv- og smartphone-skærme, lysemitterende indikatorer og som belysning til biler og fly med særlige krav. Vi -
 AlScN – alternativt materiale til mere effektiv smartphone-hardwareBearbejdede overflade akustiske bølgestrukturer (SAW) på AlScN/Si-lag (venstre) og AlScN/Al2O3-lag (højre). Kredit:Fraunhofer-Gesellschaft 5G mobile dataoverførsler kræver brug af flere og højere
AlScN – alternativt materiale til mere effektiv smartphone-hardwareBearbejdede overflade akustiske bølgestrukturer (SAW) på AlScN/Si-lag (venstre) og AlScN/Al2O3-lag (højre). Kredit:Fraunhofer-Gesellschaft 5G mobile dataoverførsler kræver brug af flere og højere -
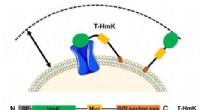 Zombie-scanning muliggør undersøgelse af peptid-receptor-interaktioner på celleoverfladenDet bundne toksin (T-HmK) trækkes fri og bindes til en kaliumkanal (blå) udtrykt i cellemembranen. Reaktionsvolumenet, som en T-HmK kan besøge (pil med to hoveder) bestemmes af de kombinerede længder
Zombie-scanning muliggør undersøgelse af peptid-receptor-interaktioner på celleoverfladenDet bundne toksin (T-HmK) trækkes fri og bindes til en kaliumkanal (blå) udtrykt i cellemembranen. Reaktionsvolumenet, som en T-HmK kan besøge (pil med to hoveder) bestemmes af de kombinerede længder -
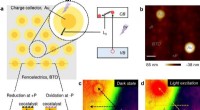 Forskere foreslår ny ladningsadskillelsesstrategi i ferroelektriske fotokatalysatorerLadningsadskillelse ved meta/ferroelektrisk grænseflade. et skematisk diagram af foreslået metal/ferroelektrisk fotokatalysator. b AFM-topografi af Au-partikler på en BaTiO3 enkelt krystal. Målestok,
Forskere foreslår ny ladningsadskillelsesstrategi i ferroelektriske fotokatalysatorerLadningsadskillelse ved meta/ferroelektrisk grænseflade. et skematisk diagram af foreslået metal/ferroelektrisk fotokatalysator. b AFM-topografi af Au-partikler på en BaTiO3 enkelt krystal. Målestok,
- Injektionsbrønde kan fremkalde jordskælv miles væk fra brønden
- Når en bølge bevæger sig gennem en åbning i barriere?
- Billede:Glacial efterskælv gyder Antarktis isbjerg
- Sådan rengøres en Herkimer Diamond
- Hvilken type energi bruges til at bage en kage?
- Hvorfor beta -partikler trænger dybt ind i faste stoffer?


