Årsagen til at rent vand har en pH på 7 er, at der den samme koncentration brint og hydroxidioner på selvioniseringsvand?
* selvionisering af vand: Vandmolekyler (H₂O) kan spontant reagere med hinanden og danne en hydroniumion (H₃O⁺) og en hydroxidion (OH⁻).
* H₂O + H₂O ⇌ H₃O⁺ + OH⁻
* ligevægt: Denne reaktion når ligevægt, hvilket betyder, at hastigheden for fremad- og omvendte reaktioner er ens. Ved ligevægt er koncentrationerne af hydroniumioner og hydroxidioner lige.
* pH og POH:
* pH er et mål for koncentrationen af hydroniumioner (H₃O⁺).
* POH er et mål for koncentrationen af hydroxidioner (OH⁻).
* neutral pH: Når koncentrationerne af H₃O⁺ og OH⁻ er ens, er pH og POH også ens. Da pH -skalaen er logaritmisk, repræsenterer en pH på 7 en neutral opløsning, hvor koncentrationerne af H₃O⁺ og OH⁻ begge er 10⁻⁷ mol pr. Liter.
Derfor fører den lige koncentration af brint (H⁺) og hydroxid (OH⁻) ioner i rent vand på grund af selvionisering til dens neutrale pH på 7.
 Varme artikler
Varme artikler
-
 Nydesignede ligander til en katalytisk reaktion til syntetisering af lægemidler og nyttige forbinde…Tetrasubstituerede kromanoner er nyttige til lægemiddeldesign, men en effektiv strategi for deres generation har manglet indtil nu. Kredit:Gwangju Institute of Science and Technology I øjeblikket,
Nydesignede ligander til en katalytisk reaktion til syntetisering af lægemidler og nyttige forbinde…Tetrasubstituerede kromanoner er nyttige til lægemiddeldesign, men en effektiv strategi for deres generation har manglet indtil nu. Kredit:Gwangju Institute of Science and Technology I øjeblikket, -
 Forskere udvikler forfalskede sprit-detektionsanordningerKredit:University of Manchester Forskere ved University of Manchester har udviklet verdens første håndholdte SORS-enhed, der kan opdage falske spiritus, såsom vodka og whisky, mens de stadig er i
Forskere udvikler forfalskede sprit-detektionsanordningerKredit:University of Manchester Forskere ved University of Manchester har udviklet verdens første håndholdte SORS-enhed, der kan opdage falske spiritus, såsom vodka og whisky, mens de stadig er i -
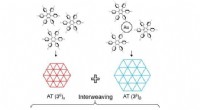 Meget kompleks todimensionel tessellation i den molekylære verdenFigur viser tre typer af meget komplekse sammenvævede tesselleringer baseret på to forskellige molekylære faser konstrueret af en enkelt molekylær byggesten. Kredit:Nature Communications Tessellat
Meget kompleks todimensionel tessellation i den molekylære verdenFigur viser tre typer af meget komplekse sammenvævede tesselleringer baseret på to forskellige molekylære faser konstrueret af en enkelt molekylær byggesten. Kredit:Nature Communications Tessellat -
 Forskere udvikler en ny metode til levering af glukagonSihan Yu og Matthew Webber. Kredit:University of Notre Dame For børn med type 1-diabetes, risikoen for at opleve en alvorlig hypoglykæmisk episode er særlig almindelig – og for forældre, truslen o
Forskere udvikler en ny metode til levering af glukagonSihan Yu og Matthew Webber. Kredit:University of Notre Dame For børn med type 1-diabetes, risikoen for at opleve en alvorlig hypoglykæmisk episode er særlig almindelig – og for forældre, truslen o
- Hvad er produkterne fra reaktionskaliumchlorat?
- Open source tilgang giver hurtigere, bedre opløselighedsforudsigelser
- 99 grader Fahrenheit er hvor mange Celsius?
- Vil du løse verdens problemer? Prøv at arbejde sammen på tværs af discipliner
- Hvornår stiger solen om sommeren?
- Pen tegner fleksible kredsløb ved hjælp af en halv meter lange carbon nanorørfibre


