Hvad er en enkelt forbindelse?
* elementer: Grundlæggende byggesten af stof, som kulstof, brint, ilt osv.
* kemisk bundet: Atomerne i forskellige elementer holdes sammen af kræfter kaldet kemiske bindinger.
* fast forhold: Elementerne er altid til stede i den samme andel i en given forbindelse.
Eksempler på enkeltforbindelser:
* vand (H₂O): To hydrogenatomer bundet til et iltatom.
* natriumchlorid (NaCl): Et natriumatom bundet til et chloratom.
* kuldioxid (co₂): Et carbonatom bundet til to iltatomer.
* glukose (c₆h₁₂o₆): Seks carbonatomer, tolv hydrogenatomer og seks iltatomer bundet i et specifikt arrangement.
Nøglepunkter:
* rene stoffer: Forbindelser betragtes som rene stoffer, hvilket betyder, at de har en ensartet sammensætning overalt.
* forskellige egenskaber: Forbindelser har unikke egenskaber, der er forskellige fra de elementer, der udgør dem. For eksempel er vand en væske ved stuetemperatur, mens brint og ilt er gasser.
Kontrast med blandinger:
I modsætning til blandinger, hvor forskellige stoffer er fysisk kombineret, dannes forbindelser gennem kemiske reaktioner, der skaber nye stoffer med forskellige egenskaber.
 Varme artikler
Varme artikler
-
 Denne RNA-baserede teknik kunne gøre genterapi mere effektivKredit:CC0 Public Domain Levering af funktionelle gener til celler for at erstatte muterede gener, en metode kendt som genterapi, har potentiale til behandling af mange former for sygdomme. De tid
Denne RNA-baserede teknik kunne gøre genterapi mere effektivKredit:CC0 Public Domain Levering af funktionelle gener til celler for at erstatte muterede gener, en metode kendt som genterapi, har potentiale til behandling af mange former for sygdomme. De tid -
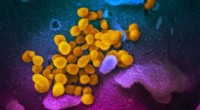 Fordelene ved rekonvalescent plasma til COVID-19 er stadig uklareDette scanningselektronmikroskopbillede viser SARS-CoV-2 (gul)-også kendt som 2019-nCoV, virussen, der forårsager COVID-19-isoleret fra en patient, der kommer fra overfladen af celler (blå/pink) dyr
Fordelene ved rekonvalescent plasma til COVID-19 er stadig uklareDette scanningselektronmikroskopbillede viser SARS-CoV-2 (gul)-også kendt som 2019-nCoV, virussen, der forårsager COVID-19-isoleret fra en patient, der kommer fra overfladen af celler (blå/pink) dyr -
 Planter modellerer mere effektiv termisk afkølingsmetodePatricia Weisensee og hendes laboratorium studerede temperaturen og fordampningsadfærden af en dråbe fastgjort til en lodret overflade. Kredit:Weisensee Lab Når vanddråber rører overfladen af
Planter modellerer mere effektiv termisk afkølingsmetodePatricia Weisensee og hendes laboratorium studerede temperaturen og fordampningsadfærden af en dråbe fastgjort til en lodret overflade. Kredit:Weisensee Lab Når vanddråber rører overfladen af -
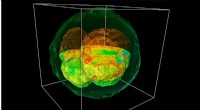 Ny mikroskopteknik afslører indre struktur af levende embryonerEt GLIM billede af et gengivet ko-embryo, der blev skåret gennem midten for at afsløre indre strukturer. Kredit:Billede udlånt af Gabriel Popescu Forskere fra University of Illinois har udviklet e
Ny mikroskopteknik afslører indre struktur af levende embryonerEt GLIM billede af et gengivet ko-embryo, der blev skåret gennem midten for at afsløre indre strukturer. Kredit:Billede udlånt af Gabriel Popescu Forskere fra University of Illinois har udviklet e
- Rovdyr og bytte i cyberstasis
- Hvordan forbliver Lo Europa Ganymede og Callisto i kredsløb omkring Jupiter?
- En ny udviklingsforstærkende læringstilgang til sansemotorisk rumudvidelse
- Hvorfor tager planeter forskellige tidspunkter for at bane solen?
- Hvad er en almindelig kilde til stråling Jorden?
- Hvilke landformer har tempererede løvskove?


