Hvordan konverterer du et neutralt svovlatom til en anion, der bærer ladning på -2?
forståelse af det grundlæggende
* Neutral svovl: Et neutralt svovlatom har 16 protoner (positiv ladning) og 16 elektroner (negativ ladning), hvilket resulterer i en nettoafgift på 0.
* anion: En anion er et atom eller molekyle, der har vundet en eller flere elektroner, hvilket giver det en negativ ladning.
konverteringen
1. Elektrongevinst: Svovl skal få to elektroner for at opnå en -2 -ladning. Dette skyldes, at svovl, som alle atomer, stræber efter at opnå en stabil elektronkonfiguration som de ædle gasser. For svovl betyder det at have 8 elektroner i sin yderste skal.
2. Elektronkonfiguration:
* Neutral svovl (er):1S² 2S² 2p⁶ 3S² 3P⁴ (har 6 elektroner i sin yderste skal)
* Sulfid Anion (S²⁻):1S² 2S² 2P⁶ 3S² 3P⁶ (har nu 8 elektroner i sin yderste skal, som Argon)
Repræsentation
Konverteringen kan repræsenteres af følgende ligning:
S + 2E⁻ → S²⁻
Kortfattet
For at omdanne et neutralt svovlatom til en sulfidanion (S²⁻) skal der tilsættes to elektroner til dets elektronsky. Denne proces resulterer i en stabil elektronkonfiguration og en -2 ladning på svovlatomet.
 Varme artikler
Varme artikler
-
 Energibesparelse ved fremstilling af kemikalierDr. Michael Bortz (til venstre) og prof. Karl-Heinz Küfer fra Fraunhofer ITWM modtager Joseph von Fraunhofer-prisen for udviklingen af et analyseværktøj, der kan spare energi i det tocifrede procent
Energibesparelse ved fremstilling af kemikalierDr. Michael Bortz (til venstre) og prof. Karl-Heinz Küfer fra Fraunhofer ITWM modtager Joseph von Fraunhofer-prisen for udviklingen af et analyseværktøj, der kan spare energi i det tocifrede procent -
 Ænder giver forskere en unik mulighed for at studere menneskelig berøringEt lysarkmikroskopbillede af embryonal andenæshud farvet med Tuj1-antistoffer til at mærke sensoriske neuroner. Kredit:Slav Bagriantsev Hvis den går som en and (eller en gås eller en svane), den k
Ænder giver forskere en unik mulighed for at studere menneskelig berøringEt lysarkmikroskopbillede af embryonal andenæshud farvet med Tuj1-antistoffer til at mærke sensoriske neuroner. Kredit:Slav Bagriantsev Hvis den går som en and (eller en gås eller en svane), den k -
 Forskere udvikler sikrere elektrokrom blækPrøver viser nogle af de farver, forskere har produceret i elektrokrome polymerer. Materialerne kan bruges til anvendelser såsom solbriller og rudefarvning, der kan tændes og slukkes ved påføring af e
Forskere udvikler sikrere elektrokrom blækPrøver viser nogle af de farver, forskere har produceret i elektrokrome polymerer. Materialerne kan bruges til anvendelser såsom solbriller og rudefarvning, der kan tændes og slukkes ved påføring af e -
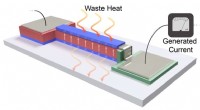 Tynd film omdanner varme fra elektronik til energiEn illustration af, hvordan tynd-film enhedssystemet omdanner spildvarme til energi. Kredit:Shishir Pandya Næsten 70 procent af den energi, der produceres i USA hvert år, går til spilde som varme.
Tynd film omdanner varme fra elektronik til energiEn illustration af, hvordan tynd-film enhedssystemet omdanner spildvarme til energi. Kredit:Shishir Pandya Næsten 70 procent af den energi, der produceres i USA hvert år, går til spilde som varme.
- Hvor er den indkommende Suns -energi mest koncentreret?
- Verdens mest kraftfulde mikroskop klar til forskning
- Ikke noget, der hedder en plastfri frokost?
- Hvilken teori binder felterne inden for biologi og geologi sammen?
- Hvad sker der, når testrøret, der indeholder grønt pigment, anbringes i kogende vand?
- Hvorfor ser solen ud som at bevæge sig?


