Hvorfor findes carbon ikke i den elektrokemiske serie?
Her er hvorfor:
* stærk kovalent binding: Kulstof danner meget stærke kovalente bindinger, hvilket gør det vanskeligt at bryde disse bindinger og formioner. Carbon foretrækker at dele elektroner i stedet for at vinde eller miste dem for at opnå en stabil oktet.
* begrænset reaktivitet: Carbons lave reaktivitet gør det modstandsdygtigt over for oxidation eller reduktion i de mest almindelige vandige opløsninger.
* Mangel på metallicitet: Den elektrokemiske serie fokuserer primært på metaller, der let danner kationer (positivt ladede ioner) i opløsning. Carbon, der er ikke-metal, udviser ikke denne opførsel.
I stedet for at blive inkluderet i den elektrokemiske serie, diskuteres kulstof typisk i sammenhæng med:
* Elektrokemi af organiske forbindelser: Carbon er et nøgleelement i organisk kemi, og dets rolle i elektrokemi undersøges ofte i sammenhæng med organiske reaktioner og elektrodeprocesser.
* carbonbaserede elektroder: Kulstofmaterialer, såsom grafit og aktivt carbon, bruges ofte som elektroder i forskellige elektrokemiske anordninger på grund af deres ledningsevne og elektrokemisk stabilitet.
Kortfattet , Carbon's unikke kemiske egenskaber, inklusive dens stærke kovalente binding og mangel på metallisk karakter, forhindrer det i at blive inkluderet i den traditionelle elektrokemiske serie. Imidlertid spiller det betydelige roller i elektrokemi gennem dens involvering i organiske forbindelser og brugen af kulstofbaserede elektroder.
 Varme artikler
Varme artikler
-
 En ny fluorescerende probe, der kan skelne B-celler fra T-cellerFigur 1. A) Splenocytter blev isoleret fra musemilt, og T- og B -celler blev adskilt ved anvendelse af magnetisk aktiveret cellesortering (MACS). Cellerne blev efterfølgende udpladet i 384 brønde og o
En ny fluorescerende probe, der kan skelne B-celler fra T-cellerFigur 1. A) Splenocytter blev isoleret fra musemilt, og T- og B -celler blev adskilt ved anvendelse af magnetisk aktiveret cellesortering (MACS). Cellerne blev efterfølgende udpladet i 384 brønde og o -
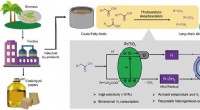 Forskere bruger lys til at omdanne fedtsyrer til alkanerSkematisk repræsentation af fotokatalytisk decarboxyleringsstrategi for alkanproduktion fra biomasseafledte fedtsyrer. Kredit:Huang Zhipeng Forskere ledet af prof. Wang Feng ved Dalian Institute o
Forskere bruger lys til at omdanne fedtsyrer til alkanerSkematisk repræsentation af fotokatalytisk decarboxyleringsstrategi for alkanproduktion fra biomasseafledte fedtsyrer. Kredit:Huang Zhipeng Forskere ledet af prof. Wang Feng ved Dalian Institute o -
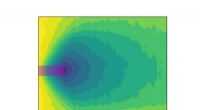 Nanocylindervibrationer hjælper med at kvantificere polymerhærdning til 3D-printFarvelagt plot af lys-assisteret hærdning af en polymer over fem sekunder, som målt med NISTs brugerdefinerede atomkraftmikroskop med en nanocylindersonde. Mørkere farver indikerer et højere niveau af
Nanocylindervibrationer hjælper med at kvantificere polymerhærdning til 3D-printFarvelagt plot af lys-assisteret hærdning af en polymer over fem sekunder, som målt med NISTs brugerdefinerede atomkraftmikroskop med en nanocylindersonde. Mørkere farver indikerer et højere niveau af -
 Instrumentet kan muliggøre mail-in test til at detektere tungmetaller i vandMIT -kandidatstuderende Emily Hanhauser demonstrerer en ny enhed, der kan forenkle logistikken ved vandovervågning for spormetalforureninger, især i ressourcebegrænsede regioner. Kredit:Melanie Gonick
Instrumentet kan muliggøre mail-in test til at detektere tungmetaller i vandMIT -kandidatstuderende Emily Hanhauser demonstrerer en ny enhed, der kan forenkle logistikken ved vandovervågning for spormetalforureninger, især i ressourcebegrænsede regioner. Kredit:Melanie Gonick


