Når natriummetal reagerer med klorgas til dannelse af chlorid, hvad vil hvert atom gøre?
natrium (NA):
* mister en elektron: Natrium har en elektron i sin yderste skal. Den ønsker at have en fuld ydre skal (som de ædle gasser), så det mister let den enkelte elektron for at blive en positivt ladet ion (Na⁺).
* danner en kation: Tabet af et elektron forlader natrium med en +1 ladning, hvilket gør det til en kation.
klor (CL):
* får en elektron: Klor har syv elektroner i sin yderste skal. Den vil have en fuld ydre skal på otte, så den får let et elektron til at blive en negativt ladet ion (CL⁻).
* danner en anion: Gevinsten af et elektron giver klor en -1 -ladning, hvilket gør det til en anion.
ionisk bindingsdannelse:
* Elektrostatisk attraktion: Den positivt ladede natriumion (Na⁺) tiltrækkes stærkt af den negativt ladede chloridion (CL⁻). Denne elektrostatiske attraktion er det, der danner den ioniske binding.
* Dannelse af NaCl: De modsatte ladede ioner mødes for at danne forbindelsen natriumchlorid (NaCl), almindeligvis kendt som tabel salt.
Kortfattet:
* natrium (NA) mister en elektron og bliver NA⁺ (kation).
* klor (CL) får en elektron og bliver CL⁻ (anion).
* de modsatte ladede ioner tiltrækker hinanden til at danne den ioniske sammensatte NaCl.
Sidste artikelHvilket mineral har en hårdhed på 2,5-3 og gør en god elektrisk isolator?
Næste artikelHvilken form er natriumhydroxid?
 Varme artikler
Varme artikler
-
 Søger efter egenskaberne ved prisvindende vinKredit:WSU Prisvindende vine har en tendens til at være mere komplekse, og de bedste har høje ethanol- og sukkerniveauer. Det er konstateringen af et nyligt papir i Journal of Wine Research f
Søger efter egenskaberne ved prisvindende vinKredit:WSU Prisvindende vine har en tendens til at være mere komplekse, og de bedste har høje ethanol- og sukkerniveauer. Det er konstateringen af et nyligt papir i Journal of Wine Research f -
 Bæredygtig, stærkt selektiv biokatalytisk omdannelse af aldehyder til carboxylsyrerForsidebillede af den aktuelle udgave af Green Chemistry med HIMS/Biocat -forskningen. Forskere fra University of Amsterdams Vant Hoff Institute for Molecular Sciences (HIMS) har udviklet den førs
Bæredygtig, stærkt selektiv biokatalytisk omdannelse af aldehyder til carboxylsyrerForsidebillede af den aktuelle udgave af Green Chemistry med HIMS/Biocat -forskningen. Forskere fra University of Amsterdams Vant Hoff Institute for Molecular Sciences (HIMS) har udviklet den førs -
 Forbedring af sammensætningen af strålebeskyttelsesbrillerForskere vælger den optimale sammensætning af briller, som vil have stærke beskyttende egenskaber, klarhed og miljøvenlighed. Kredit:UrFU / Anastasia Farafontova. Forskere ved Ural Federal Universi
Forbedring af sammensætningen af strålebeskyttelsesbrillerForskere vælger den optimale sammensætning af briller, som vil have stærke beskyttende egenskaber, klarhed og miljøvenlighed. Kredit:UrFU / Anastasia Farafontova. Forskere ved Ural Federal Universi -
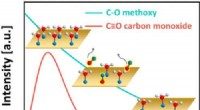 Uventet adfærd set i effektive katalysatorer til ren energiGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.1c05933 Forskere fra Weizmann Institute of Science og US Department of Energys (DOE) Brookhaven National Laboratory har undersøgt
Uventet adfærd set i effektive katalysatorer til ren energiGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.1c05933 Forskere fra Weizmann Institute of Science og US Department of Energys (DOE) Brookhaven National Laboratory har undersøgt
- Er motion en fysisk eller kemisk ændring?
- Kinas rumdrøm:En lang march til månen og videre
- NASA finder tyfonen Maysak i bevægelse nær Okinawa, Japan
- Forskerholdet opnår hurtig og pålidelig stuetemperatur phosphorescens chiral genkendelse
- Enzymer fra farlige bakterier bliver til vigtige værktøjer til proteinkemi
- Hvad indikerer det romerske tal III i koboltoxid?


