Hvorfor er natrium og klor et godt match til fremstilling af molekyle?
* natrium (NA): Natrium har en elektron i sin yderste skal. Den ønsker at miste dette elektron for at have en fuld ydre skal og opnå en stabil elektronkonfiguration som neon. Ved at miste denne elektron bliver natrium en positivt ladet ion (Na+).
* klor (Cl): Klor har syv elektroner i sin yderste skal. Den ønsker at få en elektron for at have en fuld ydre skal og opnå en stabil elektronkonfiguration som Argon. Ved at få denne elektron bliver klor en negativt ladet ion (Cl-).
ionisk binding:
Når natrium og klor samles, mister natriumatomet sin elektron, og kloratomet får det. Denne elektronoverførsel resulterer i dannelsen af modsat ladede ioner. Tiltrækningen mellem den positivt ladede natriumion (Na+) og den negativt ladede klorion (Cl-) danner en stærk elektrostatisk attraktion kaldet en ionisk binding .
Resultat:
Den resulterende forbindelse er natriumchlorid (NaCl), almindeligvis kendt som tabel salt. Den ioniske binding mellem natrium og klor er meget stærk, hvilket gør natriumchlorid til et stabilt og krystallinsk fast stof.
Nøglepunkter:
* octet regel: Atomernes tendens til at opnå en stabil elektronkonfiguration med otte elektroner i deres yderste skal er kendt som Octet -reglen.
* Elektrostatisk attraktion: Tiltrækningen mellem modsat ladede ioner er grundlaget for ionisk binding.
I det væsentlige er natrium og klor et perfekt match, fordi deres naturlige tendenser til at vinde eller miste elektroner supplerer hinanden, hvilket fører til dannelsen af en stabil og essentiel forbindelse som salt.
Sidste artikelEr sprite en blanding eller forbindelse?
Næste artikelEr CH2O en empirisk eller molekylær formel?
 Varme artikler
Varme artikler
-
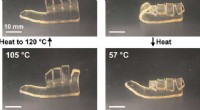 Tuning af frontal polymerisering til forskellige materialegenskaberBillederne illustrerer ændringen i polymerform afhængigt af glasovergangstemperaturen. Kredit:Autonomous Materials Systems Group. Forskere fra University of Illinois i Urbana-Champaign har forbedr
Tuning af frontal polymerisering til forskellige materialegenskaberBillederne illustrerer ændringen i polymerform afhængigt af glasovergangstemperaturen. Kredit:Autonomous Materials Systems Group. Forskere fra University of Illinois i Urbana-Champaign har forbedr -
 Field-cycling relaxometry kan vurdere tumorstatus ved at måle hastigheden af cellulær vandudveks…Hvor aggressiv er en tumor? For at måle tumorstatus uden at tage vævsprøver, Italienske forskere har udviklet en metode baseret på magnetisk resonansbilleddannelse (MRI) af hele kropsdele. Teknikken m
Field-cycling relaxometry kan vurdere tumorstatus ved at måle hastigheden af cellulær vandudveks…Hvor aggressiv er en tumor? For at måle tumorstatus uden at tage vævsprøver, Italienske forskere har udviklet en metode baseret på magnetisk resonansbilleddannelse (MRI) af hele kropsdele. Teknikken m -
 Ny tilgang foreslår vej til emissionsfri cementI en demonstration af de grundlæggende kemiske reaktioner, der blev brugt i den nye proces, elektrolyse finder sted i neutralt vand. Farvestoffer viser, hvordan syre (pink) og base (lilla) produceres
Ny tilgang foreslår vej til emissionsfri cementI en demonstration af de grundlæggende kemiske reaktioner, der blev brugt i den nye proces, elektrolyse finder sted i neutralt vand. Farvestoffer viser, hvordan syre (pink) og base (lilla) produceres -
 Forskere fandt et alternativ til vandchloreringSpecialister i (SPbPU), udviklet et unikt udstyr til kompleks vandrensning. Kredit:Peter den Store St. Petersborg Polytechnic University Forskere ved Peter den Store St.Petersburg Polytechnic Univ
Forskere fandt et alternativ til vandchloreringSpecialister i (SPbPU), udviklet et unikt udstyr til kompleks vandrensning. Kredit:Peter den Store St. Petersborg Polytechnic University Forskere ved Peter den Store St.Petersburg Polytechnic Univ
- Om hvor mange menneskelige gener er der?
- Hvorfor ser vi så mange hajer? Hvornår er det OK at jage dem?
- Ride-share-selskaber omfavner valgvanvid
- Hvordan politiets overvågningsteknologier fungerer som værktøjer til hvid overherredømme
- Hvorfor drejer alle planeterne i solsystemet om solen?
- Nedslidning af kvantevæsker af lys og stof for at undersøge superfluiditet


