Hvis flydende carbondisulfid reagerer med 4,50 x 102 ml ilt for at producere gasserdioxid og svovl, hvilket volumen hvert produkt produceres?
1. Afbalanceret kemisk ligning
Den afbalancerede kemiske ligning for reaktionen er:
CS₂ (L) + 3O₂ (G) → CO₂ (G) + 2SO₂ (G)
2. Konverter volumen ilt til mol
* Antag standard temperatur og tryk (STP):0 ° C (273,15 K) og 1 atm.
* Brug den ideelle gaslov:PV =NRT
* P =1 atm
* V =4,50 x 10² ml =0,450 L (konverter til liter)
* R =0,0821 l · atm/mol · k
* T =273,15 K
* Løs for n (mol ilt):
n =(pv) / (rt) =(1 atm * 0,450 l) / (0,0821 l · atm / mol · k * 273,15 K) ≈ 0,0201 mol o₂
3. Brug støkiometri til at finde mol af produkter
* Fra den afbalancerede ligning reagerer 3 mol O₂ på at producere 1 mol co₂ og 2 mol SO₂.
* Mol co₂:(0,0201 mol o₂) * (1 mol co₂ / 3 mol o₂) ≈ 0,00670 mol co₂
* Mol So₂:(0,0201 mol O₂) * (2 mol So₂ / 3 mol O₂) ≈ 0,0134 mol SO₂
4. Beregn volumen af produkter på STP
* Brug den ideelle gaslov igen, men løser denne gang for V.
* For co₂:
* n =0,00670 mol
* P =1 atm
* R =0,0821 l · atm/mol · k
* T =273,15 K
* V =(NRT) / P =(0,00670 mol * 0,0821 L · ATM / Mol · K * 273,15 K) / 1 ATM ≈ 0,150 L
* For så₂:
* n =0,0134 mol
* P =1 atm
* R =0,0821 l · atm/mol · k
* T =273,15 K
* V =(NRT) / P =(0,0134 mol * 0,0821 L · ATM / Mol · K * 273,15 K) / 1 atm ≈ 0,300 L
Svar:
* kuldioxid (co₂): Ca. 0,150 l
* svovldioxid (SO₂): Ca. 0,300 l
Sidste artikelHvad dannes, når natrium og klor sammenføjes?
Næste artikelEr det at blande epsom salt og ammoniak en kemisk ændring?
 Varme artikler
Varme artikler
-
 Kemikalier, der helbreder malaria, kan også dræbe ukrudtPlantebiologer ved University of Western Australia har afsløret forholdet mellem planter og parasitten, der forårsager malaria, er tæt nok til at betyde, at mange lægemidler mod malaria er effektive h
Kemikalier, der helbreder malaria, kan også dræbe ukrudtPlantebiologer ved University of Western Australia har afsløret forholdet mellem planter og parasitten, der forårsager malaria, er tæt nok til at betyde, at mange lægemidler mod malaria er effektive h -
 Forskere udvikler et nyt peptidsystem til målrettet transport af molekyler ind i levende pattedyrce…Kredit:CC0 Public Domain Et nyt peptid udviklet ved universiteterne i Bayreuth og Bristol er fremragende egnet til målrettet transport af molekyler-f.eks. aktive stoffer og farvestoffer-ind i pat
Forskere udvikler et nyt peptidsystem til målrettet transport af molekyler ind i levende pattedyrce…Kredit:CC0 Public Domain Et nyt peptid udviklet ved universiteterne i Bayreuth og Bristol er fremragende egnet til målrettet transport af molekyler-f.eks. aktive stoffer og farvestoffer-ind i pat -
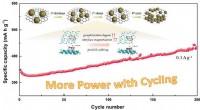 Partikelforfining inducerer og øger cykluskapaciteten af natrium/lithium-ion-batterierSkematisk diagram af mekanismen for partikelforfining for at inducere forøgelse af cykluskapaciteten af SIBer. Kredit:WANG Canpei Natriumionbatterier (SIBer) har tiltrukket bred opmærksomhed på
Partikelforfining inducerer og øger cykluskapaciteten af natrium/lithium-ion-batterierSkematisk diagram af mekanismen for partikelforfining for at inducere forøgelse af cykluskapaciteten af SIBer. Kredit:WANG Canpei Natriumionbatterier (SIBer) har tiltrukket bred opmærksomhed på -
 Tellurium gør forskellenProfessor Wolfgang Weigand fra det tyske universitet i Jena viser usædvanlige strukturer af tellurforbindelser. Kredit:Anne Günther/Uni Jena Det periodiske system indeholder 118 kemiske grundstoff
Tellurium gør forskellenProfessor Wolfgang Weigand fra det tyske universitet i Jena viser usædvanlige strukturer af tellurforbindelser. Kredit:Anne Günther/Uni Jena Det periodiske system indeholder 118 kemiske grundstoff
- Blev natvison kikkert brugt i Falklands -krigen?
- Hvilken temperaturskala placerer nul på det punkt, hvor al atomisk og molekylær bevægelse ophøre…
- Hvor mange gram MgCl2 skal der til for at lave 700.mL til en 1,4 M opløsning?
- Hvor mange sider af en halvø er omgivet af vand?
- Hvor mange iltatomer er der i 2 mol ozon?
- Hvad er en form for energi, der resulterer i, at tiltrækningsobjekter bliver lavet til jern?


