Hvilken har højere elektronaffinitetsjod eller brom?
Elektronaffinitet er ændringen i energi, der opstår, når der tilsættes et elektron til et neutralt atom i den gasformige tilstand for at danne en negativ ion.
Faktorer, der påvirker elektronaffinitet:
* atomstørrelse: Efterhånden som atomstørrelsen øges, falder elektronaffiniteten generelt. Dette skyldes, at den yderste elektron er længere væk fra kernen og oplever svagere tiltrækning.
* atomafgift: Efterhånden som atomafgiften øges, øges elektronaffiniteten generelt. Dette skyldes, at kernen udøver en stærkere attraktion på den indkommende elektron.
* afskærmningseffekt: Elektroner i indre skaller beskytter de ydre elektroner mod kernen, hvilket reducerer attraktionen.
I tilfælde af jod og brom:
* Jod er større end brom.
* Både jod og brom er i den samme gruppe (halogener) og har lignende nukleare ladninger.
På grund af sin større størrelse er den yderste elektron i jod længere væk fra kernen og oplever svagere tiltrækning sammenlignet med brom. Dette resulterer i en lavere elektronaffinitet for jod sammenlignet med brom.
Derfor har jod en højere elektronaffinitet end brom.
 Varme artikler
Varme artikler
-
 Videnskabelige fremskridt kan gøre det lettere at genanvende plastKredit:CC0 Public Domain De fleste af de 150 millioner tons plastik, der produceres rundt om i verden hvert år, ender på lossepladser, havene og andre steder. Mindre end 9 procent af plasten genan
Videnskabelige fremskridt kan gøre det lettere at genanvende plastKredit:CC0 Public Domain De fleste af de 150 millioner tons plastik, der produceres rundt om i verden hvert år, ender på lossepladser, havene og andre steder. Mindre end 9 procent af plasten genan -
 Første af sin art hydrogel-platform muliggør on-demand produktion af medicin, kemikalierEt 3D-printet hydrogelgitter indeholder gærceller, der kan muliggøre kontinuerlig produktion af ethanol. Kredit:Cockrell School of Engineering, University of Texas i Austin Et team af kemiske inge
Første af sin art hydrogel-platform muliggør on-demand produktion af medicin, kemikalierEt 3D-printet hydrogelgitter indeholder gærceller, der kan muliggøre kontinuerlig produktion af ethanol. Kredit:Cockrell School of Engineering, University of Texas i Austin Et team af kemiske inge -
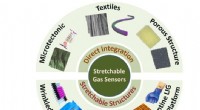 Forskere udvikler sensorer, der registrerer menneskelige biomarkører og giftig gasEt forskningshold fra Penn State, ledet af Huanyu Larry Cheng, Dorothy Quiggle Karriereudviklingsprofessor i Penn State Department of Engineering Science and Mechanics, udforsker forskellige nanomater
Forskere udvikler sensorer, der registrerer menneskelige biomarkører og giftig gasEt forskningshold fra Penn State, ledet af Huanyu Larry Cheng, Dorothy Quiggle Karriereudviklingsprofessor i Penn State Department of Engineering Science and Mechanics, udforsker forskellige nanomater -
 Spindende kemikalier for hurtigere reaktionerKredit:CC0 Public Domain Forskere fra Cardiff University har udtænkt en ny måde at lave reaktioner op til 70 gange hurtigere ved at bruge avanceret udstyr til at dreje kemikalier rundt. De fandt
Spindende kemikalier for hurtigere reaktionerKredit:CC0 Public Domain Forskere fra Cardiff University har udtænkt en ny måde at lave reaktioner op til 70 gange hurtigere ved at bruge avanceret udstyr til at dreje kemikalier rundt. De fandt
- Hvad er volkan?
- Kan det østlige USA få en femtedel af sin energi fra vind i 2024?
- Hvor på jordoverfladen skal du stå for at opleve mindst centripetal acceleration?
- Hvorfor fører erosion altid til deponering?
- Hvad er en dyb smal dal med høje stejle sider forårsaget af forvitring og erosion?
- Slået af oversvømmelser, Amerikanske flodsamfund prøver nye midler


