Når elementer er arrangeret i rækkefølge af stigende atomnummer, er der en periodisk gentagelse deres kemiske og fysiske egenskaber erklæring?
Her er en mere komplet forklaring:
Den periodiske lov siger, at de kemiske og fysiske egenskaber ved elementer er periodiske funktioner i deres atomnumre.
Dette betyder, at når elementer er arrangeret i rækkefølge af stigende atomnummer, gentager deres egenskaber i et regelmæssigt mønster. Dette mønster er repræsenteret i den periodiske tabel, hvor elementer med lignende egenskaber grupperes sammen i kolonner (grupper) og rækker (perioder).
Her er nogle centrale aspekter af den periodiske lov:
* atomnummer: Antallet af protoner i en atoms kerne.
* Kemiske egenskaber: Hvordan et element interagerer med andre elementer for at danne forbindelser.
* Fysiske egenskaber: Egenskaber som smeltepunkt, kogepunkt, densitet og ledningsevne.
* Periodisk gentagelse: Lignende egenskaber gentager sig på en regelmæssig måde, når du bevæger dig over og ned ad den periodiske tabel.
Eksempler:
* alkalimetaller (gruppe 1): Meget reaktive metaller, alle har en valenselektron.
* halogener (gruppe 17): Reaktive ikke -metaller, alle har syv valenselektroner.
* ædle gasser (gruppe 18): Ureaktive gasser har alle en fuld ydre skal af elektroner.
Den periodiske lov er et grundlæggende princip inden for kemi, der giver os mulighed for at forstå og forudsige opførsel af elementer baseret på deres position i den periodiske tabel.
 Varme artikler
Varme artikler
-
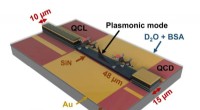 Miniaturiseret lab-on-a-chip til kemisk analyse af væsker i realtidOn-chip sensorkoncept inklusive angivet plasmonisk tilstand. Emitter (QCL, 10 μm bred) og detektor (QCD, 15 μm bred) er forbundet gennem en 48 μm lang tilspidset SiN-baseret plasmonisk bølgeleder. Hel
Miniaturiseret lab-on-a-chip til kemisk analyse af væsker i realtidOn-chip sensorkoncept inklusive angivet plasmonisk tilstand. Emitter (QCL, 10 μm bred) og detektor (QCD, 15 μm bred) er forbundet gennem en 48 μm lang tilspidset SiN-baseret plasmonisk bølgeleder. Hel -
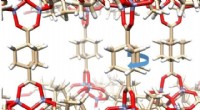 Gyroskopmolekyler danner krystal, der er både fast og fuld af bevægelseUCLA -forskere dannede en krystal ud af molekyler, der hver har et solidt ydre, men indeholder bevægelige dele. Kredit:Kendall Houk Laboratory/UCLA Molekylære maskiner, meget mindre end enkeltcell
Gyroskopmolekyler danner krystal, der er både fast og fuld af bevægelseUCLA -forskere dannede en krystal ud af molekyler, der hver har et solidt ydre, men indeholder bevægelige dele. Kredit:Kendall Houk Laboratory/UCLA Molekylære maskiner, meget mindre end enkeltcell -
 Forskere etablerer ny måde at teste for lægemiddelresistente infektionerForskerholdet arbejder nu med klinikere på York Teaching Hospital NHS Foundation Trust for at integrere dette modificerede antibiotikum i en hurtig diagnostisk test for antimikrobiel resistens ved uri
Forskere etablerer ny måde at teste for lægemiddelresistente infektionerForskerholdet arbejder nu med klinikere på York Teaching Hospital NHS Foundation Trust for at integrere dette modificerede antibiotikum i en hurtig diagnostisk test for antimikrobiel resistens ved uri -
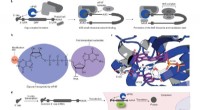 Biokemikere bruger nyt værktøj til at kontrollere mRNA ved hjælp af lys5′-hætten er et kendetegn for eukaryote mRNAer, der styrer translationsinitiering. a, Nøgletrin i oversættelsesinitiering. Den eukaryote translationsinitieringsfaktor eIF4E binder direkte til 5′-hætte
Biokemikere bruger nyt værktøj til at kontrollere mRNA ved hjælp af lys5′-hætten er et kendetegn for eukaryote mRNAer, der styrer translationsinitiering. a, Nøgletrin i oversættelsesinitiering. Den eukaryote translationsinitieringsfaktor eIF4E binder direkte til 5′-hætte
- Cassini-rumfartøjet dykker mellem Saturn og dens ringe, tilbage i kontakt med Jorden
- 3-D afgrødebilleddannelse hjælper landbruget med at vurdere plantehøjden
- Hvad er tætheden af Moon Europa?
- Hvilken type pladegrænse er at skabe MT -hætte?
- Hvad er valensen af ammoniumsulfat?
- Er bjergkæder en konstruktiv eller destruktiv kraft?


