Hvad er pH på 10 mol pr. Liter natriumhydroxidopløsning?
forståelse af koncepterne
* natriumhydroxid (NaOH): En stærk base, der fuldstændigt adskiller sig i vand, hvilket betyder, at den frigiver alle sine hydroxidioner (OH-) til opløsning.
* ph: Et mål for surhedsgraden eller alkaliniteten af en opløsning. PH -skalaen varierer fra 0 til 14:
* 0-6:Syre
* 7:Neutral
* 8-14:Grundlæggende (alkalisk)
* POH: Et mål for hydroxidionkoncentration. POH og pH er relateret af ligningen:Ph + POH =14
Beregninger
1. Find POH:
* Da NaOH er en stærk base, er koncentrationen af hydroxidioner ([OH-]) lig med koncentrationen af NaOH, som er 10 mol/l.
* poh =-log [oh-] =-log (10) =-1
2. Find pH:
* pH + POH =14
* pH =14 - POH =14 - (-1) =15
Vigtig note: En pH -værdi på 15 er ekstremt grundlæggende og ligger uden for det typiske interval for pH -skalaen. Dette skyldes, at koncentrationen af natriumhydroxidopløsningen er meget høj. En sådan høj koncentration opstår sjældent i hverdagssituationer.
Kortfattet:
PH af en 10 mol/l natriumhydroxidopløsning er 15.
Sidste artikelHvordan reagerer jernchlorid med kaliumiodidopløsning?
Næste artikelReagerer natrium med vand en fysisk ændring?
 Varme artikler
Varme artikler
-
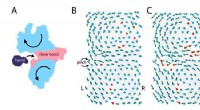 Sådan kodes en funktionel molekylær maskineFigur 1:Elastisk model af et protein, der binder til en ligand. (A) Når et protein binder til en ligand, det gennemgår store bevægelser (pile), som er signaturerne for bøjede funktionelle proteiner. D
Sådan kodes en funktionel molekylær maskineFigur 1:Elastisk model af et protein, der binder til en ligand. (A) Når et protein binder til en ligand, det gennemgår store bevægelser (pile), som er signaturerne for bøjede funktionelle proteiner. D -
 Sjældne jordarter bliver kun vandafvisende, når de bliver ældreOxider af sjældne jordarter (rød/orange) reagerer med gasformige organiske forbindelser fra den omgivende luft og danner carbonater og hydroxider (grå/hvid). Gennem denne reaktion, overfladen udvikler
Sjældne jordarter bliver kun vandafvisende, når de bliver ældreOxider af sjældne jordarter (rød/orange) reagerer med gasformige organiske forbindelser fra den omgivende luft og danner carbonater og hydroxider (grå/hvid). Gennem denne reaktion, overfladen udvikler -
 Banebrydende materiale kan føre til billigere, mere udbredte solpaneler og elektronikKredit:University of Kansas Forestil dig at udskrive elektroniske enheder ved hjælp af en simpel inkjet-printer - eller endda male et solpanel på væggen i en bygning. En sådan teknologi ville red
Banebrydende materiale kan føre til billigere, mere udbredte solpaneler og elektronikKredit:University of Kansas Forestil dig at udskrive elektroniske enheder ved hjælp af en simpel inkjet-printer - eller endda male et solpanel på væggen i en bygning. En sådan teknologi ville red -
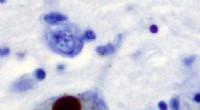 Ny enzymnøgle til bedre behandling af Parkinsons sygdomImmunhistokemi for alfa-synuclein, der viser positiv farvning (brun) af et intraneuralt Lewy-legeme i Substantia nigra ved Parkinsons sygdom. Kredit:Wikipedia Forskere har opdaget et nyt enzym, de
Ny enzymnøgle til bedre behandling af Parkinsons sygdomImmunhistokemi for alfa-synuclein, der viser positiv farvning (brun) af et intraneuralt Lewy-legeme i Substantia nigra ved Parkinsons sygdom. Kredit:Wikipedia Forskere har opdaget et nyt enzym, de
- Hvad sker der, når et stof går direkte fra fast tilstand til gas, som tøris gør?
- Hvad er enheder for kraft?
- Hvad er en form for energi, der rejser fra sol til jorden?
- Ny undersøgelse fjerner gætværket ved at udvælge og seede hold til March Madness
- Video:Går rumaffald nogensinde i stykker?
- Google muliggør brug af Android -telefoner som en fysisk sikkerhedsnøgle


