Hvilke løsninger har den højeste elektriske ledningsevne 0,1 M NaCl BaCl2 ALCL3?
Forståelse af elektrisk ledningsevne
Elektrisk ledningsevne i løsninger afhænger af følgende:
* Antal ioner: Flere ioner i opløsning betyder flere ladningsbærere, hvilket fører til højere ledningsevne.
* opladning på ionerne: Højere ladede ioner bidrager mere til konduktivitet.
* Mobilitet af ionerne: Ioner, der bevæger sig lettere gennem opløsningen (mindre størrelse, mindre interaktion med vandmolekyler) vil bidrage mere til konduktivitet.
analyse af løsningen
Lad os nedbryde hver løsning:
* 0,1 m NaCl: Opløses i na⁺ og cl⁻ioner.
* 0,1 m bacl₂: Opløses i ba²⁺ og 2 cl⁻ioner (bemærk den højere ladning på ba²⁺ionen).
* 0,1 m alcl₃: Opløses i al³⁺ og 3 cl⁻ioner (igen, den højere ladning på al³⁺ion).
Vinderen:Alcl₃
* de fleste ioner: ALCL₃ producerer flest ioner pr. Mol opløst stof (4 ioner i alt).
* Højeste opladning: Al³⁺ bærer en +3 ladning, hvilket bidrager væsentligt til ledningsevne.
Derfor vil 0,1 m alcl₃ have den højeste elektriske ledningsevne.
Vigtig note: Den faktiske ledningsevne vil også blive påvirket af faktorer som temperatur og opløsningsmidlets egenskaber. I denne sammenligning giver det at fokusere på antallet og ladningen af ioner os imidlertid en god forudsigelse.
 Varme artikler
Varme artikler
-
 Brug af en porøs porphyrin til at genvinde ædle metaller fra elektronisk affaldPorøs porfyrinpolymer (COP-180) kan udvinde guld fra et computerkredsløb og producere rene guldklumper. Kredit:Yeongran Hong Et internationalt hold af forskere har brugt en porøs porphyrin til at
Brug af en porøs porphyrin til at genvinde ædle metaller fra elektronisk affaldPorøs porfyrinpolymer (COP-180) kan udvinde guld fra et computerkredsløb og producere rene guldklumper. Kredit:Yeongran Hong Et internationalt hold af forskere har brugt en porøs porphyrin til at -
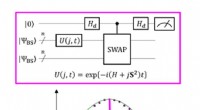 Gentænke spinkemi fra et kvanteperspektivEt kvantekredsløb, der muliggør den maksimale sandsynlighed for P(0) ved måling af parameteren J. Kredit:K. Sugisaki, K. Sato og T. Takui Forskere ved Osaka City University bruger kvantesuperposit
Gentænke spinkemi fra et kvanteperspektivEt kvantekredsløb, der muliggør den maksimale sandsynlighed for P(0) ved måling af parameteren J. Kredit:K. Sugisaki, K. Sato og T. Takui Forskere ved Osaka City University bruger kvantesuperposit -
 Hurtig, præcis og ikke-destruktiv:Den nye metode til at analysere fødevarekvalitetNIRS analyse af spinatplanter direkte i marken. Kredit:Universidad de Córdoba Forbrugerne leder altid efter produkter af god kvalitet, frem for alt i frisk mad som grøntsager. Men hvordan måler vi
Hurtig, præcis og ikke-destruktiv:Den nye metode til at analysere fødevarekvalitetNIRS analyse af spinatplanter direkte i marken. Kredit:Universidad de Córdoba Forbrugerne leder altid efter produkter af god kvalitet, frem for alt i frisk mad som grøntsager. Men hvordan måler vi -
 Indfangning og omdannelse af kuldioxid til et nyttigt produktForskningen er støttet af Carbontec Energy. Kredit:Michigan Technological University Kuldioxid er en ballademager. Så det er en god idé at fjerne det fra kraftværksemissioner - og det kan have en
Indfangning og omdannelse af kuldioxid til et nyttigt produktForskningen er støttet af Carbontec Energy. Kredit:Michigan Technological University Kuldioxid er en ballademager. Så det er en god idé at fjerne det fra kraftværksemissioner - og det kan have en
- Hvor varme var oceanerne, da livet først udviklede sig?
- NASA-NOAA satellit analyserer regnmageren orkanen Florence
- Den store planetariske forbindelse i 2020
- Skjult kilde til kulstof fundet ved den arktiske kyst
- Hvilken jordbaseret planet har ingen atmosfære?
- Hvad er tre ting, der sætter kuldioxid i luften ved at brænde?


