Hvilke af disse stoffer har det højeste smeltepunkt ALCL3 NaCl KCL eller RBCL?
Forståelse af smeltepunkt
Smeltepunkt er den temperatur, hvormed en solid overgår til en væske. Styrken af kræfterne, der holder partiklerne sammen i fast tilstand, bestemmer smeltepunktet. Stærkere kræfter kræver mere energi (højere temperatur) for at bryde.
ioniske forbindelser og smeltepunkt
De forbindelser, du har listet, er alle ioniske forbindelser. Styrken af den ioniske binding, som er den elektrostatiske tiltrækning mellem modsat ladede ioner, bestemmer smeltepunktet. Sådan gælder de faktorer, der påvirker ionisk bindingsstyrke, på din liste:
* opladning: Højere afgifter på ionerne fører til stærkere attraktioner.
* størrelse: Mindre ioner har større ladningstæthed, hvilket fører til stærkere attraktioner.
Sammenligning af forbindelserne
* alcl3: Aluminium har en +3 ladning, og klor har en -1 -ladning. Imidlertid har ALCL3 en mere kovalent karakter på grund af størrelsesforskellen mellem ionerne.
* NaCl: Natrium har en +1 ladning, og klor har en -1 -ladning.
* kcl: Kalium har en +1 ladning, og klor har en -1 -ladning. Kalium er større end natrium.
* rbcl: Rubidium har en +1 ladning, og klor har en -1 -afgift. Rubidium er større end kalium.
Konklusion
Baseret på ovenstående faktorer har NaCl det højeste smeltepunkt. Her er hvorfor:
* opladning: Alle fire forbindelser har den samme størrelsesorden af ladning (+1 og -1).
* størrelse: Natrium- og klorioner er mindre end kalium og klor og endnu mindre end rubidium og klor. Mindre ioner har stærkere attraktioner.
Derfor vil NaCl have det højeste smeltepunkt efterfulgt af KCL, RBCL og derefter ALCL3.
Sidste artikelHvad er sulfurs gennemsigtighed?
Næste artikelHvorfor udførte NaCl og CaCl2 ALCL3 elektrisk forskelligt?
 Varme artikler
Varme artikler
-
 Bygger molekyler som Tinkertoys? Et banebrydende studie kan bane vejenEt team af kemikere ved University of Chicago annoncerede en ny teknik, der gør det muligt for forskere let at skære nitrogenatomer fra molekyler-hvilket kan gøre processen med at finde nye molekyler
Bygger molekyler som Tinkertoys? Et banebrydende studie kan bane vejenEt team af kemikere ved University of Chicago annoncerede en ny teknik, der gør det muligt for forskere let at skære nitrogenatomer fra molekyler-hvilket kan gøre processen med at finde nye molekyler -
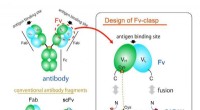 Nyt lille antistoffragment - et værdifuldt værktøj i krystallografiFigur 1. Designkoncept af et nyt antistoffragmentformat Fv-lås. Fv-lås er en simpel fusion af SARAH-domænet afledt af humant Mst1-protein til Fv (grøn:tung kæde, cyan:let kæde) fragment af et antistof
Nyt lille antistoffragment - et værdifuldt værktøj i krystallografiFigur 1. Designkoncept af et nyt antistoffragmentformat Fv-lås. Fv-lås er en simpel fusion af SARAH-domænet afledt af humant Mst1-protein til Fv (grøn:tung kæde, cyan:let kæde) fragment af et antistof -
 Et levende lys-lignende skær fra en fleksibel organisk LEDEn bøjelig organisk LED med en naturlig glimmerbagside frigiver en stærk, levende lys-lignende glød. Kredit:Andy Chen og Ambrose Chen Stearinlys giver en behagelig glød og sætter stemningen til en
Et levende lys-lignende skær fra en fleksibel organisk LEDEn bøjelig organisk LED med en naturlig glimmerbagside frigiver en stærk, levende lys-lignende glød. Kredit:Andy Chen og Ambrose Chen Stearinlys giver en behagelig glød og sætter stemningen til en -
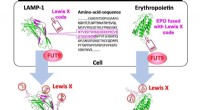 Forskerhold identificerer en molekylær kode indlejret i protein til regulering af dets glykosylerin…Specifik 29-aminosyresekvens fra LAMP-1 tjener som en Lewis X-kode, som dechifreres af FUT9, og den kan indlejres i erythropoietin for at fremkalde Lewis X-modifikation. Kredit:Nagoya City University
Forskerhold identificerer en molekylær kode indlejret i protein til regulering af dets glykosylerin…Specifik 29-aminosyresekvens fra LAMP-1 tjener som en Lewis X-kode, som dechifreres af FUT9, og den kan indlejres i erythropoietin for at fremkalde Lewis X-modifikation. Kredit:Nagoya City University
- Hvilke to hovedgasser findes i solen?
- Flere Basra-vandkriser, medmindre den irakiske regering løser fejl:HRW
- Viser læsningen af Speedometer en bilhastighed eller hastighedsbil?
- Hvad er to eksempler på en hårtørrer, der konverterer energi?
- Spørg os nogetanobjekt med en masse på 8 g er i frit fald. Hvilken hastighed efter den er faldet i…
- Overfører stråling til fast objekt?


