Nyt lille antistoffragment - et værdifuldt værktøj i krystallografi
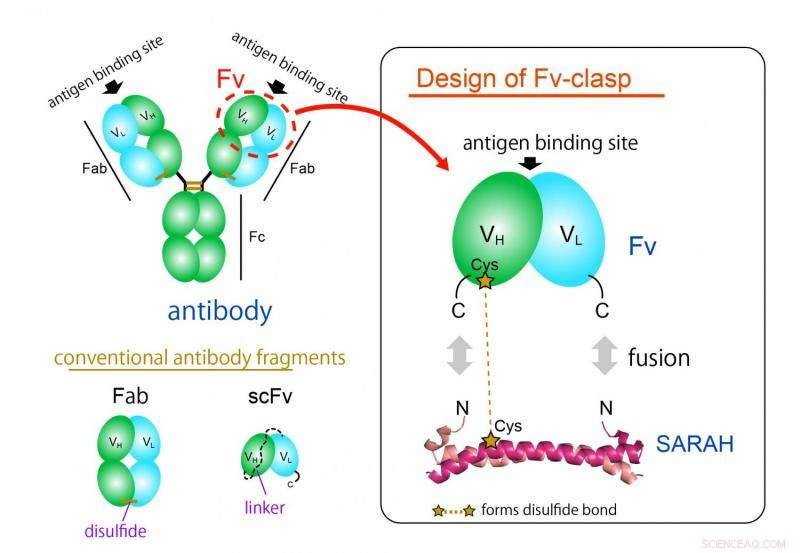
Figur 1. Designkoncept af et nyt antistoffragmentformat "Fv-lås". Fv-lås er en simpel fusion af SARAH-domænet afledt af humant Mst1-protein til Fv (grøn:tung kæde, cyan:let kæde) fragment af et antistof. VH/VL-dimer stabiliseres af dimer-konformationen af SARAH-domænet (mørk og lys magenta). Kredit:Osaka University
Antistoffer er et kraftfuldt våbensystem til at forsvare vores krop mod angribere som bakterier og vira. Hvert antistof består af fire aminosyrepolypeptidkæder:to tunge kæder og to lette kæder forbundet for at danne et Y-formet molekyle. Antistoffer genkender et specifikt antigen, der er unikt for dets mål, da de besidder de antigenbindingssteder, der er placeret ved de øvre spidser af Y. Mens antistofbaserede terapier er blevet etableret som lægemidler i frontlinjen, der er gjort lidt fremskridt i brugen af antistoffer som forskningsværktøjer til opdagelse af små molekyler, især inden for røntgenkrystallografi.
Røntgenkrystallografi er en teknik, der bruger røntgendiffraktionsmønstre til at bestemme høj opløsning, tredimensionelle strukturer af molekyler såsom proteiner, små organiske molekyler, og materialer. Den største udfordring i røntgenkrystallografiske tilgange er fortsat produktionen af højkvalitets diffraktionskrystaller.
I de seneste år, der er stigende brug af antistoffragmenter som krystallisations-chaperoner for at hjælpe med den strukturelle bestemmelse af ellers "ukrystalliserbare" eller "udugelige" målproteiner. Grundlaget for strategien er at øge sandsynligheden for at opnå velordnede krystaller ved at minimere den konformationelle heterogenitet i målproteinet.
Det mest almindeligt anvendte antistoffragmentformat er Fab-formatet, men det er vanskeligt at producere i bakterielle ekspressionssystemer på grund af dets store og komplekse struktur. Fv-fragmentet af antistoffet, som kun indeholder en tung og en let kæde, ville være ideel til denne applikation takket være dens enkle og lille arkitektur. Imidlertid, Fv bruges sjældent, fordi de to kæder let adskilles, fører til tab af funktion.

Figur.2. Krystalstruktur af Fv-lås. Faktisk tredimensionel struktur af Fv-lås bestemt ved røntgenkrystallografisk analyse. Kredit:Osaka University
Nu, et team af forskere fra Osaka University har designet et nyt enkeltkædet Fv-fragment med forbedret produktionskompatibilitet, stabilitet og krystallisation, samtidig med at det oprindelige molekyles bindingsevne bevares. De har for nylig offentliggjort deres resultater i Structure.
"Vi producerede med succes et nyt fragment ved at fusionere en anti-parallel spiral-spiral-struktur afledt af et bestemt domæne af et humant enzym, Mst1 kinase, til antigenbindingsstederne af et antistof, " studielederforfatter Takao Arimori forklarer. "Det resulterende kimære molekyle, Fv-spænde, var funktionelt og strukturelt ækvivalent med Fv for det originale antistof. "
Især skift fra Fab til Fv-spænde-format forbedrede markant den antistof-assisterede krystallisering af to biologisk vigtige proteiner, de ekstracellulære domæner integrin a6b1 og sorLasorLA. Integrin a6b1 spiller en væsentlig rolle i vedhæftningen af iPS -celler og ES -celler samt mange levercancerceller til basalmembranen, et ekstracellulært proteinnetværksfundament til stede i væv i de fleste celler og organer, mens sorLA er proteinreceptor impliceret i Alzheimers sygdom.
"Den universelle anvendelighed af Fv-låsens design til storstilet og billig produktion gør den ønskværdig til industrielle anvendelser. Desuden, dens høje varmestabilitet er en stor fordel for immunterapier, " siger den tilsvarende forfatter Junichi Takagi. "Bortset fra området for strukturel biologi, vi forventer, at Fv-låsens design vil bidrage til udvidelsen af allerede fremtrædende antistofbrug i både grundlæggende og anvendte videnskaber."
 Varme artikler
Varme artikler
-
 Biologer lærte infusoria at bekæmpe giftstofferAntioxidanter modvirker de negative virkninger af brintoverilte på infusorians overlevelse Paramecium caudatum . Det ses, at antioxidanterne øger overlevelsesraten for infusorian i hydrogenperoxidop
Biologer lærte infusoria at bekæmpe giftstofferAntioxidanter modvirker de negative virkninger af brintoverilte på infusorians overlevelse Paramecium caudatum . Det ses, at antioxidanterne øger overlevelsesraten for infusorian i hydrogenperoxidop -
 Transport af molekylære motorer til ciliaBilledet øverst viser en sædcelle med hoved (cellekrop) og hale (også kendt som flagellum eller cilium), der driver sædcellen fremad. Skemaet i midten viser, hvordan dyneinmotorer (gule stjerner) tran
Transport af molekylære motorer til ciliaBilledet øverst viser en sædcelle med hoved (cellekrop) og hale (også kendt som flagellum eller cilium), der driver sædcellen fremad. Skemaet i midten viser, hvordan dyneinmotorer (gule stjerner) tran -
 Kemiske reaktioner bryder fri fra energibarrierer ved at bruge flyby-banerEn illustration, der viser et molekyles bevægelse hen over en potentiel energioverflade på den måde, vandrere følger konturkortet over bjerge og dale langs en sti. Når der påføres en mekanisk kraft, e
Kemiske reaktioner bryder fri fra energibarrierer ved at bruge flyby-banerEn illustration, der viser et molekyles bevægelse hen over en potentiel energioverflade på den måde, vandrere følger konturkortet over bjerge og dale langs en sti. Når der påføres en mekanisk kraft, e -
 Forskere udvikler nye metoder til at skabe mikrofluidiske enheder med fluorpolymererRepræsentative fluorpolymermikrokanaler, der er fyldt med vand, der indeholder vandige farvestoffer. Kredit:SUTD En lang række applikationer er baseret på mikrofluidiske enheder lavet af silikoneg
Forskere udvikler nye metoder til at skabe mikrofluidiske enheder med fluorpolymererRepræsentative fluorpolymermikrokanaler, der er fyldt med vand, der indeholder vandige farvestoffer. Kredit:SUTD En lang række applikationer er baseret på mikrofluidiske enheder lavet af silikoneg
- porøs, ultralav-temperatur superkondensatorer kunne drive Mars, polar missioner
- Antacida hjælper tuberkulosebakterier med at overleve
- Genoplivning af Brasiliens oprindelige sprog
- Tyskland finder vognmænd snyd for at skjule emissioner
- Forskning afdækker pålidelighedsproblemer for kulstofnanorør i fremtidens elektronik
- Sydafrika bruger ny teknologi til at bekæmpe ond våbenvold


