Hvilket volumen ilt ved STPI'er var nødvendigt for at reagere med 1,50 mol C2H4?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen mellem ethen (C₂H₄) og ilt (O₂) producerer kuldioxid (CO₂) og vand (H₂O):
C₂H₄ + 3O₂ → 2CO₂ + 2H₂O
2. Bestem molforholdet:
Fra den afbalancerede ligning ser vi, at 1 mol C₂H₄ reagerer med 3 mol O₂.
3. Beregn molen af O₂ nødvendigt:
Da vi har 1,50 mol c₂h₄, har vi brug for:
1,50 mol c₂h₄ × (3 mol o₂ / 1 mol c₂h₄) =4,50 mol o₂
4. Anvend den ideelle gaslov:
Ved STP (standardtemperatur og tryk):
* Temperatur (t) =273,15 k
* Tryk (p) =1 atm
* Ideel gaskonstant (R) =0,0821 L · ATM/Mol · K
Den ideelle gaslov er:PV =NRT
Vi kan omarrangere dette for at løse for volumen (v):
V =NRT / P
5. Beregn mængden af O₂:
V =(4,50 mol) (0,0821 L · ATM / mol · K) (273,15 K) / (1 atm)
V ≈ 101 l
Derfor har du brug for cirka 101 liter ilt ved STP for at reagere med 1,50 mol ethen.
 Varme artikler
Varme artikler
-
 Sammensætning af multikomponentlegeringer ved screening med høj gennemstrømningFigur 1:(a) Skematisk diagram over høj gennemløb, (b) fysisk skygge maske. Kredit:© Science China Press Multikomponentmaterialer er blandt de mest lovende materialer inden for teknik og biomedicin
Sammensætning af multikomponentlegeringer ved screening med høj gennemstrømningFigur 1:(a) Skematisk diagram over høj gennemløb, (b) fysisk skygge maske. Kredit:© Science China Press Multikomponentmaterialer er blandt de mest lovende materialer inden for teknik og biomedicin -
 Glycaner fandt binding til pattedyr -RNAKredit:CC0 Public Domain Et team af forskere ved Stanford University har fundet tegn på glycaner, der binder sig til pattedyr -RNA. Gruppen har skrevet et papir, der beskriver deres resultater og
Glycaner fandt binding til pattedyr -RNAKredit:CC0 Public Domain Et team af forskere ved Stanford University har fundet tegn på glycaner, der binder sig til pattedyr -RNA. Gruppen har skrevet et papir, der beskriver deres resultater og -
 Forskere foreslår ny koblingsstrategi for organisk spildevandsrensningGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121858 En fælles forskergruppe ledet af prof. Sun Chenglin, prof. Wei Huangzhao og prof. Li Rengui fra Dalian Ins
Forskere foreslår ny koblingsstrategi for organisk spildevandsrensningGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121858 En fælles forskergruppe ledet af prof. Sun Chenglin, prof. Wei Huangzhao og prof. Li Rengui fra Dalian Ins -
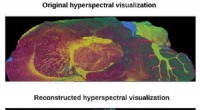 Beregningsmetode giver hurtigere højopløsnings massespektrometrisk billeddannelseTop, hyperspektral visualisering med data fra et standard 9-timers eksperiment sammenlignet med hyperspektral visualisering med data fra et foreslået 1-timers eksperiment. Kredit:Beckman Institute for
Beregningsmetode giver hurtigere højopløsnings massespektrometrisk billeddannelseTop, hyperspektral visualisering med data fra et standard 9-timers eksperiment sammenlignet med hyperspektral visualisering med data fra et foreslået 1-timers eksperiment. Kredit:Beckman Institute for
- Ny teknologi kan tilbyde billigere, hurtigere mad test
- Hvad er hastigheden for magnetbånd?
- Hvad er forskellen mellem pyrit og guld?
- Cit eksempler på astronomiske fænomener, der er kendt af astronomer inden adventteleskopet?
- Fra sorte huller til sand:Anvendelse af holografisk dualitet til granuleret stof
- Børns race, ikke handicapstatus, kan forudsige hyppigere suspension


