Hvad er atomer med det samme element, som thay har forskellige atommasser?
Her er en sammenbrud:
* Element: Et rent stof bestående af kun en type atom. Alle atomer i et givet element har det samme antal protoner (definerer elementets atomnummer).
* atommasse: Den samlede masse af et atom, primært bestemt af antallet af protoner og neutroner i dens kerne.
* isotoper: Atomer med det samme element, der har det samme antal protoner, men forskellige antal neutroner. Denne forskel i neutroner resulterer i en anden atommasse.
for eksempel:
* carbon-12 og carbon-14 er begge isotoper af kulstof.
* Begge har 6 protoner (definerer dem som kulstof).
* Carbon-12 har 6 neutroner, mens carbon-14 har 8 neutroner.
* Dette gør atommassen af carbon-12 12 og atommassen af carbon-14 14.
Isotoper har forskellige fysiske egenskaber, såsom radioaktivt forfald, og kan bruges i forskellige anvendelser som:
* Radioaktiv dating (Carbon-14 dating)
* Medicinsk billeddannelse (TechNetium-99m)
* Kræftbehandling (Cobalt-60)
Fortæl mig, hvis du har flere spørgsmål!
 Varme artikler
Varme artikler
-
 Selvhelbredende kompositter forlænger produktets levetidKredit:CompPair Næsten 20 millioner tons polymerkompositmaterialer produceres hvert år verden over, og markedet vokser med omkring 5% årligt. Det er ifølge JEC, en international sammensætningsindu
Selvhelbredende kompositter forlænger produktets levetidKredit:CompPair Næsten 20 millioner tons polymerkompositmaterialer produceres hvert år verden over, og markedet vokser med omkring 5% årligt. Det er ifølge JEC, en international sammensætningsindu -
 Jagten på bæredygtige læderalternativerKredit:Pixabay/CC0 Public Domain Igennem historien, læder har været et populært materiale til tøj og mange andre varer. Imidlertid, garvningsprocessen og brugen af husdyr betyder, at den har et
Jagten på bæredygtige læderalternativerKredit:Pixabay/CC0 Public Domain Igennem historien, læder har været et populært materiale til tøj og mange andre varer. Imidlertid, garvningsprocessen og brugen af husdyr betyder, at den har et -
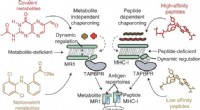 Forskere afslører molekylært grundlag for antigenbehandling for cancermål MR1Grafisk abstrakt. Kredit:Nature Chemical Biology (2022). DOI:10.1038/s41589-022-01049-9 I en ny undersøgelse offentliggjort i Nature Chemical Biology , har forskere ved Childrens Hospital of Philad
Forskere afslører molekylært grundlag for antigenbehandling for cancermål MR1Grafisk abstrakt. Kredit:Nature Chemical Biology (2022). DOI:10.1038/s41589-022-01049-9 I en ny undersøgelse offentliggjort i Nature Chemical Biology , har forskere ved Childrens Hospital of Philad -
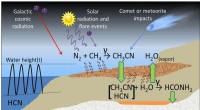 Opstod vandbaseret liv uden vand?Foreslået proces til formamidsyntese nær radioaktive mineralaflejringer på Jordens overflade. Kredit:Adam et al. Udgivet i Videnskabelige rapporter . Når man forsøger at forstå oprindelsen af
Opstod vandbaseret liv uden vand?Foreslået proces til formamidsyntese nær radioaktive mineralaflejringer på Jordens overflade. Kredit:Adam et al. Udgivet i Videnskabelige rapporter . Når man forsøger at forstå oprindelsen af
- Er Twisted Mystery of Fast Radio Bursts blevet løst?
- Hvad er de tre situationer for at ændre hastigheden?
- Nyt instrument kunne søge efter signaturer af liv på Mars
- Hvad er en kraft, der trak i modsatte retninger kaldet?
- Hvad består af kun et atom og har et kemisk symbol kan ikke opdeles i enklere stoffer?
- Sjove fakta om dvale og bjørne til børnehavebørn


