Forskere afslører molekylært grundlag for antigenbehandling for cancermål MR1
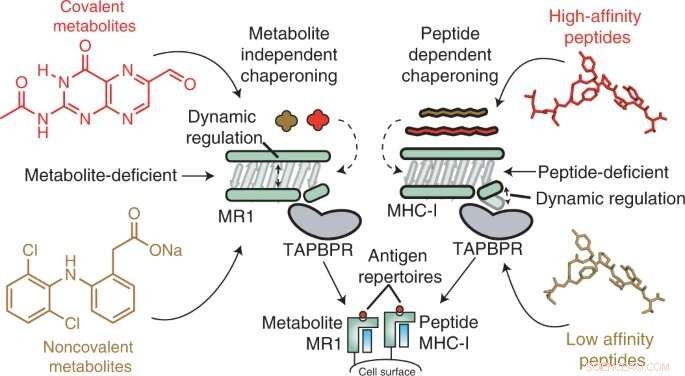
Grafisk abstrakt. Kredit:Nature Chemical Biology (2022). DOI:10.1038/s41589-022-01049-9
I en ny undersøgelse offentliggjort i Nature Chemical Biology , har forskere ved Children's Hospital of Philadelphia (CHOP) afsløret den molekylære mekanik af et celleoverflademolekyle, der er et potentielt immunterapimål. Ved hjælp af sofistikerede teknikker, herunder nuklear magnetisk resonans (NMR) spektroskopi, demonstrerede forskerne vigtigheden af såkaldte chaperone-molekyler til at stabilisere dette mål, kendt som MHC-I-relateret protein 1 (MR1).
Større histokompatibilitetskompleks klasse I (MHC-I) molekyler lever på overfladen af næsten alle celler og præsenterer peptidantigener til immunsystemet, så immunceller kan detektere, når et fremmed antigen er til stede, såsom dem fra bakterier, vira eller selv udvikle tumorer. I en lignende proces præsenterer det MHC-I-relaterede protein 1 (MR1) mindre metabolitter på overfladen til overvågning af MR1-specifikke immunceller, nemlig slimhindeassocierede invariante T-celler (MAIT).
MR1 er kendt for at være vigtig for genkendelse af mikrobielle infektioner, identifikation af kræftceller i modsætning til raske og regulering af autoimmun sygdom. Nylige undersøgelser tyder også på, at MR1 kan vise et meget bredere udvalg af molekyler, herunder kræftspecifikke metabolitter, som kan tjene som interne sensorer for sygdom. Derudover varierer MR1 ikke på tværs af den menneskelige befolkning, hvilket gør det til et lovende potentielt immunterapimål. Men forud for denne undersøgelse var MR1's molekylære mekanik ukendt - specifikt chaperonmolekylernes rolle i at genkende og stabilisere MR1-molekyler.
Ved hjælp af in vitro- og celleteknikker fandt forskerne ud af, at MR1 fungerer anderledes end MHC-I, især når det kommer til molekylær belastning og affinitet for de molekylære chaperoner Tapasin og TAPBPR. Mens MHC-1 viste en høj affinitet for molekylære chaperoner, når den var tom, men lav affinitet, når den var fyldt med præsenterende antigener, interagerede MR1 i lige så lave niveauer med TAPBPR, uanset om den var fyldt med metabolitter eller ej. På trods af kompleksets korte levetid brugte forskere NMR til med succes at bestemme dets 3D-struktur i et fysiologisk relevant, vandigt miljø. Interessant nok gjorde disse lavaffinitetsinteraktioner stadig chaperoner i stand til at katalysere belastning og udveksling af metabolitmolekyler direkte på MR1-overfladen.
"Vores resultater giver et grundlag for at bruge molekylære chaperoner til at stabilisere MR1-molekyler og til at muliggøre belastning og præsentation af antigener direkte på celleoverfladen," siger Nikolaos G. Sgourakis, Ph.D., lektor i Center for Computational and Genomic Medicine på Children's Hospital of Philadelphia og seniorforfatter af undersøgelsen. "Fremtidig forskning bør screene biblioteker af metabolitter for at se, hvilke der viser høj affinitet for binding til MR1. Forskere kan derefter overveje måder at øge MR1 overfladeekspression på, potentielt ved at fremme mere stabile MR1/chaperone interaktioner via flere tilgange, såsom brugen af små molekyler ." + Udforsk yderligere
Undersøgelse afslører dynamikken i vigtige immunsystemproteiner
 Varme artikler
Varme artikler
-
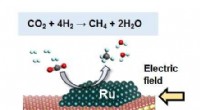 Ny metode omdanner kuldioxid til metan ved lave temperaturerHydrogenering af CO2 til CH4. Kredit:Sekine Laboratory, Waseda Universitet En ny metode udviklet af et team af Waseda-universitetets forskere under ledelse af professor Yasushi Sekine kan bidrage
Ny metode omdanner kuldioxid til metan ved lave temperaturerHydrogenering af CO2 til CH4. Kredit:Sekine Laboratory, Waseda Universitet En ny metode udviklet af et team af Waseda-universitetets forskere under ledelse af professor Yasushi Sekine kan bidrage -
 Svovl giver et lovende næste generations batterialternativEn skematisk illustration af dannelsen af kemisk bindingsstabiliseret kulstof-svovlkomposit. Kredit:C. Luo Med den stigende efterspørgsel efter økonomisk overkommelig og bæredygtig energi, den l
Svovl giver et lovende næste generations batterialternativEn skematisk illustration af dannelsen af kemisk bindingsstabiliseret kulstof-svovlkomposit. Kredit:C. Luo Med den stigende efterspørgsel efter økonomisk overkommelig og bæredygtig energi, den l -
 Mikroovn nye materialerHvis du ser omhyggeligt i midten af dette billede, du vil se den $30 mikrobølgeovn, som Reeja Jayan omkonstruerede til at starte sine tidlige eksperimenter. Kredit:Reeja Jayan Mikrobølgeovne er
Mikroovn nye materialerHvis du ser omhyggeligt i midten af dette billede, du vil se den $30 mikrobølgeovn, som Reeja Jayan omkonstruerede til at starte sine tidlige eksperimenter. Kredit:Reeja Jayan Mikrobølgeovne er -
 Sådan beregnes molariteten ved blandingNår opløsninger med forskellige koncentrationer blandes, vil koncentrationen af den resulterende blanding være forskellig fra en af udgangsopløsningerne. Molaritet er det mål for koncentration, de
Sådan beregnes molariteten ved blandingNår opløsninger med forskellige koncentrationer blandes, vil koncentrationen af den resulterende blanding være forskellig fra en af udgangsopløsningerne. Molaritet er det mål for koncentration, de
- Robot bruger maskinlæring til at høste salat
- 5G:en revolution ikke uden risici
- Hvordan tilpasser dyrene sig til den tempererede regnskov?
- Anholdelser af seks-årige viser farerne ved at sætte politi i folkeskoler
- Trumps offshore olieboringsplaner ignorerer erfaringerne fra BP Deepwater Horizon
- Japansk rumskrammelsamler i problemer


