Natrium vil reagere med ilt til dannelse af natriumoxid Brug formlen nedenfor Bestem, hvor mange gram der dannes, hvis der anvendes 46 som reaktion?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen mellem natrium (Na) og ilt (O₂) danner natriumoxid (Na₂o):
4 na + o₂ → 2 na₂o
2. Bestem de molære masser:
* Natrium (NA):22,99 g/mol
* Oxygen (O₂):32,00 g/mol
* Natriumoxid (Na₂o):61,98 g/mol
3. Konverter gram med natrium til mol:
* Du har 46 g natrium.
* Mol Na =(46 g) / (22,99 g / mol) =2 mol
4. Brug molforholdet fra den afbalancerede ligning:
* Ligningen viser et 4:2 -molforhold mellem natrium (Na) og natriumoxid (Na₂o). Dette betyder for hver 4 mol natrium, du får 2 mol natriumoxid.
5. Beregn mol af natriumoxid:
* Da du har 2 mol natrium, producerer du (2 mol na) * (2 mol na₂o / 4 mol na) =1 mol na₂o
6. Konverter mol af natriumoxid til gram:
* Gram Na₂o =(1 mol) * (61,98 g/mol) =61,98 g
Svar: Du vil danne 61,98 gram af natriumoxid, hvis 46 gram natrium anvendes i reaktionen.
Sidste artikelHvorfor N2 er inert gas?
Næste artikelHvad er formelligningen brintgas reagerer med fluor for at producere fluorgas?
 Varme artikler
Varme artikler
-
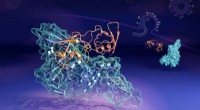 Neutroner fanger formskiftende coronavirus-proteinkompleks på aktenKredit:Oak Ridge National Laboratory Mens alle vira har nogle midler til at bekæmpe kroppens immunsystem, forskere har undersøgt, hvordan SARS-CoV-2-coronavirus - årsagen til den globale COVID-19-
Neutroner fanger formskiftende coronavirus-proteinkompleks på aktenKredit:Oak Ridge National Laboratory Mens alle vira har nogle midler til at bekæmpe kroppens immunsystem, forskere har undersøgt, hvordan SARS-CoV-2-coronavirus - årsagen til den globale COVID-19- -
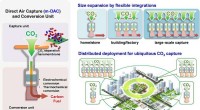 Membraner til at opfange kuldioxid fra luftenTeknologiske løsninger for CO2-emissionen til atmosfæren bør omfatte forskellige tilgange, da der ikke findes én silver bullet-løsning. I dette arbejde, forskere fra I2CNER, Kyushu University og NanoM
Membraner til at opfange kuldioxid fra luftenTeknologiske løsninger for CO2-emissionen til atmosfæren bør omfatte forskellige tilgange, da der ikke findes én silver bullet-løsning. I dette arbejde, forskere fra I2CNER, Kyushu University og NanoM -
 Methanolbiotransformation muliggør effektiv produktion af fedtsyrer fra gærKredit:Pixabay/CC0 Public Domain Fedtsyrer og deres derivater er lovende råvarer til fremstilling af avancerede biobrændstoffer, rengøringsmidler, smøremidler, overfladeaktive stoffer og så videre.
Methanolbiotransformation muliggør effektiv produktion af fedtsyrer fra gærKredit:Pixabay/CC0 Public Domain Fedtsyrer og deres derivater er lovende råvarer til fremstilling af avancerede biobrændstoffer, rengøringsmidler, smøremidler, overfladeaktive stoffer og så videre. -
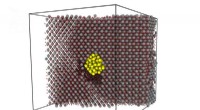 Forskere finder forklaring på unormalt hurtig frigivelse af gas fra atombrændstofEksempel på en beregningscelle:et krystalgitter af urandioxid (grå atomer er uran, røde atomer - ilt) indeholdende en boble af xenon (gule atomer). Uranatomer forskudt til inter-nodale positioner er v
Forskere finder forklaring på unormalt hurtig frigivelse af gas fra atombrændstofEksempel på en beregningscelle:et krystalgitter af urandioxid (grå atomer er uran, røde atomer - ilt) indeholdende en boble af xenon (gule atomer). Uranatomer forskudt til inter-nodale positioner er v
- Når nationer lover at genoprette økosystemer ved COP26, kan de så garantere succes?
- Miljøeffekt af papirplader
- Hvad er de korrekte mikroskopprocedurer?
- Hvordan man støtter elever i virtuelle læringsmiljøer
- Om hvor mange forskellige typer organismer har forskere opdaget indtil videre?
- NASA opretter et proxy -kort for oversvømmelser over områder, der er ramt af den tropiske storm Ba…


