Hvorfor N2 er inert gas?
* Triple Bond: Nitrogenatomer deler tre par elektroner og danner en meget stærk tredobbelt binding. Denne binding er ekstremt stabil og kræver en betydelig mængde energi for at bryde.
* Dissociation Energy: Den tredobbelte binding i N2 har en høj bindingsdissocieringsenergi, hvilket betyder, at det kræver en masse energi at bryde bindingen og danne nye obligationer med andre elementer. Dette gør det vanskeligt for nitrogen at reagere med andre stoffer.
* Ureaktiv karakter: Nitrogens ureaktive natur forbedres yderligere af dens lille atomstørrelse og høj elektronegativitet. Dette gør det vanskeligt for andre atomer at nærme sig nitrogenatomer og danne bindinger.
Det er dog vigtigt at bemærke:
* Mens nitrogen betragtes som inert under normale forhold, kan det stadig deltage i kemiske reaktioner.
* For eksempel reagerer nitrogen med visse metaller ved høje temperaturer for at danne nitrider.
* Det spiller også en afgørende rolle i biologiske processer som nitrogenfiksering, hvor bakterier omdanner atmosfærisk nitrogen til anvendelige former for planter.
Kortfattet: N2s inertness tilskrives primært dens stærke tredobbelte binding og dissociation med høj binding, hvilket gør det vanskeligt at bryde og danne nye obligationer. Selvom det generelt er ureaktivt, kan det stadig deltage i visse kemiske reaktioner under specifikke forhold.
 Varme artikler
Varme artikler
-
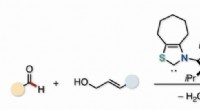 Partnere i katalyse:En effektiv vej til umættede ketonerDen samvirkende virkning af en organokatalysator og en palladiumkatalysator muliggjorde en første dehydrerende direkte allylering mellem aldehyder og allylalkoholer for at producere β, γ-umættede keto
Partnere i katalyse:En effektiv vej til umættede ketonerDen samvirkende virkning af en organokatalysator og en palladiumkatalysator muliggjorde en første dehydrerende direkte allylering mellem aldehyder og allylalkoholer for at producere β, γ-umættede keto -
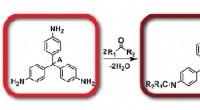 Navngiv det skotske:Kolorimetrisk genkendelse af aldehyder og ketonerKredit:Wiley Vodka smager anderledes end brandy, og kendere kan skelne mellem forskellige whiskymærker. Smagen af spiritus er et resultat af en kompleks buket af flygtige forbindelser. Nye kolor
Navngiv det skotske:Kolorimetrisk genkendelse af aldehyder og ketonerKredit:Wiley Vodka smager anderledes end brandy, og kendere kan skelne mellem forskellige whiskymærker. Smagen af spiritus er et resultat af en kompleks buket af flygtige forbindelser. Nye kolor -
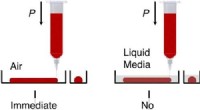 En simpel metode til at printe plane mikrostrukturer af polysiloxanKredit:Singapore University of Technology and Design Polysiloxan er en elastisk polymer, der er meget udbredt i fluidics, optik, og biomedicinsk teknik. Det tilbyder ønskværdige egenskaber til mik
En simpel metode til at printe plane mikrostrukturer af polysiloxanKredit:Singapore University of Technology and Design Polysiloxan er en elastisk polymer, der er meget udbredt i fluidics, optik, og biomedicinsk teknik. Det tilbyder ønskværdige egenskaber til mik -
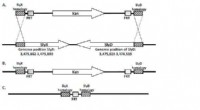 Nye teknologier til fremstilling af medicinske terapeutiske proteiner(A) KanR-kassetten flankeret af SlyX- og SlyD-homologe regioner. (B) Hele sekvensen af disse gener erstattes af KanR-kassetten under rekombination. (C) FRT ar er alt, hvad der er tilbage, når stamme
Nye teknologier til fremstilling af medicinske terapeutiske proteiner(A) KanR-kassetten flankeret af SlyX- og SlyD-homologe regioner. (B) Hele sekvensen af disse gener erstattes af KanR-kassetten under rekombination. (C) FRT ar er alt, hvad der er tilbage, når stamme


