Hvordan opfører partikler sig ved sit kogepunkt?
1. Øget kinetisk energi: Partiklerne har nok kinetisk energi til at overvinde de attraktive kræfter, der holder dem sammen i flydende tilstand. Dette betyder, at de bevæger sig hurtigere og med mere energi end ved lavere temperaturer.
2. Faseændring: Partiklerne overgår fra væsken til den gasformige tilstand. Dette betyder, at de slipper fri fra overfladen af væsken og slipper ud i de omgivende luft som gasmolekyler.
3. Konstant temperatur: Selvom der tilsættes energi til systemet, forbliver temperaturen konstant ved kogepunktet. Dette skyldes, at energien bruges til at overvinde de intermolekylære kræfter og ændre stoftilstanden, ikke for at øge partiklernes kinetiske energi.
4. Øget afstand og uorden: Partiklerne i den gasformige tilstand er langt længere fra hinanden end i flydende tilstand. De bevæger sig tilfældigt og uafhængigt uden et fast arrangement.
5. Damptryk =atmosfærisk tryk: Ved kogepunktet er væskens damptryk for det flydende lig med det atmosfæriske tryk. Dette er det punkt, hvor de flugtende gasmolekyler udøver nok pres til at overvinde presset fra den omgivende atmosfære.
6. Ligevægt: Ved kogepunktet findes der en dynamisk ligevægt mellem de flydende og gasformige faser. Dette betyder, at fordampningshastigheden (væske til gas) er lig med kondensationshastigheden (gas til væske).
Visualisering af dette:
Forestil dig en gryde med vandkogning. Vandmolekylerne bevæger sig hurtigt og kaster sig mod hinanden. Nogle har nok energi til at bryde fri fra overfladen og blive damp (gas) molekyler. Disse dampmolekyler stiger og blandes med luften. På samme tid afkøles nogle dampmolekyler og kondenseres tilbage i flydende vand og vender tilbage til gryden. Denne kontinuerlige udveksling af molekyler mellem væske- og gasfaserne er det, der kendetegner kogning.
Bemærk: Den nøjagtige opførsel ved kogepunktet kan variere lidt afhængigt af det specifikke stof. De generelle principper, der er beskrevet ovenfor, gælder imidlertid for alle stoffer.
Sidste artikelHvilke elementer er i magnesiumbromid?
Næste artikelBestem antallet af mol, der er til stede i 32,5 g aluminiumchlorid?
 Varme artikler
Varme artikler
-
 Søger uorden som en katalysator for forandringDr. Rosalie Hocking skinner lys på uordnede mineraler for at finde katalysatorer, der kan gøre vand til rent brændstof. Kredit:Swinburne University of Technology Grønne kemikere drømmer om at repl
Søger uorden som en katalysator for forandringDr. Rosalie Hocking skinner lys på uordnede mineraler for at finde katalysatorer, der kan gøre vand til rent brændstof. Kredit:Swinburne University of Technology Grønne kemikere drømmer om at repl -
 Påvisning af kulilte i kroppen kan føre til hurtig sygdomsdiagnostikKredit:Imperial College London En hurtig og pålidelig måde at påvise niveauer af kulilte i kroppen kunne give klinikere mulighed for at diagnosticere sygdom. Kulilte betragtes normalt i forhold t
Påvisning af kulilte i kroppen kan føre til hurtig sygdomsdiagnostikKredit:Imperial College London En hurtig og pålidelig måde at påvise niveauer af kulilte i kroppen kunne give klinikere mulighed for at diagnosticere sygdom. Kulilte betragtes normalt i forhold t -
 Lab-teknologi bringer nobelvindende cryo-EM i skarpere fokusKredit:Martin Hogborn/Det Kongelige Svenske Videnskabsakademi Banebrydende arbejde udført af forskere ved Department of Energys Lawrence Berkeley National Laboratory (Berkeley Lab) spillede en nøg
Lab-teknologi bringer nobelvindende cryo-EM i skarpere fokusKredit:Martin Hogborn/Det Kongelige Svenske Videnskabsakademi Banebrydende arbejde udført af forskere ved Department of Energys Lawrence Berkeley National Laboratory (Berkeley Lab) spillede en nøg -
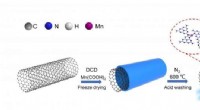 Mangan-enkeltatom-katalysator øger ydeevnen af elektrokemisk reduktion af kuldioxidSkematisk diagram af Mn SAC-fremstilling og mekanisme for elektrokemisk CO 2 reduktion. Kredit:FENG jiaqi Elektrokemisk CO 2 reduktionsreaktion (CO 2 RR) er en lovende tilgang til at omdanne
Mangan-enkeltatom-katalysator øger ydeevnen af elektrokemisk reduktion af kuldioxidSkematisk diagram af Mn SAC-fremstilling og mekanisme for elektrokemisk CO 2 reduktion. Kredit:FENG jiaqi Elektrokemisk CO 2 reduktionsreaktion (CO 2 RR) er en lovende tilgang til at omdanne


