Hvad er den kemiske egenskab ved fluor?
Nøgleegenskaber:
* Høj elektronegativitet: Fluor har den højeste elektronegativitet af alle elementer, hvilket betyder, at den stærkt tiltrækker elektroner i en binding. Dette gør det til en meget reaktiv oxidisator.
* stærkt oxidationsmiddel: Fluor vinder let elektroner og forårsager oxidationsreaktioner. Det kan oxidere de fleste andre elementer, endda ædle gasser som Xenon og Krypton.
* Meget reaktiv: Det reagerer med næsten alle elementer, ofte eksplosivt, danner stærke bånd med dem.
* farveløs gas: I sin elementære form er fluor en lysegul, meget ætsende gas ved stuetemperatur.
* stærkt reduktionsmiddel: Det kan fungere som et reduktionsmiddel i nogle tilfælde, især når man reagerer med kraftfulde oxidationsmidler.
* danner stærke obligationer: Fluor danner stærke enkeltbindinger, især med kulstof, hvorfor det er vidt brugt til syntese af mange forbindelser.
* Formularer stabile anioner: Fluor danner let fluoranionen (F-), som er en stabil, farveløs og meget opløselig ion.
* unikke egenskaber i forbindelser: Fluorens tilstedeværelse i forbindelser giver ofte unikke egenskaber, såsom øget surhedsgrad, øget reaktivitet og forbedret stabilitet.
Vigtige applikationer:
* fluorkemi: Fluor bruges til produktion af en lang række fluorerede forbindelser, herunder:
* polytetrafluoroethylen (PTFE) , kendt som Teflon, en non-stick coating, der blev brugt i mange applikationer.
* kølemidler: Fluorholdige kølemidler som Freon bruges i kølesystemer.
* farmaceutiske stoffer: Fluor anvendes til syntese af mange lægemidler, herunder antidepressiva, antiinflammatoriske midler og antivirale midler.
* Industrielle kemikalier: Fluor bruges til produktion af forskellige industrikemikalier, herunder katalysatorer og opløsningsmidler.
Sikkerhedsmæssige bekymringer:
* Meget giftig: Fluorgas er ekstremt giftig og kan forårsage alvorlige forbrændinger.
* ætsende: Det er også ætsende for de fleste materialer, herunder glas og metaller.
Kortfattet:
Fluor er et stærkt reaktivt, elektronegativt element med en kraftig oxiderende karakter. Dens unikke egenskaber har ført til dens udbredte anvendelse på forskellige områder, herunder kemi, medicin og industri. Imidlertid kræver dens reaktivitet og toksicitet omhyggelig håndtering og sikkerhedsforholdsregler.
 Varme artikler
Varme artikler
-
 Hvad giver en tre meter lang Amazonas fisk nogle af de hårdeste skæl på JordenArapaima gigas er en stor fisk i en større flod fuld af piranhaer, men det betyder ikke, at det er et nemt måltid. Ferskvandsgiganten har udviklet panserlignende skæl, der kan deformeres, men ikke r
Hvad giver en tre meter lang Amazonas fisk nogle af de hårdeste skæl på JordenArapaima gigas er en stor fisk i en større flod fuld af piranhaer, men det betyder ikke, at det er et nemt måltid. Ferskvandsgiganten har udviklet panserlignende skæl, der kan deformeres, men ikke r -
 Forskerhold udvikler bioblæk til at printe terapeutiske midler i 3-DDr. Akhilesh K. Gaharwar, adjunkt ved Institut for Biomedicinsk Teknik, leder et forskningsprojekt for at udvikle en bioink-platform til sekvestrering af terapeutiske proteiner i en 3D-printet struktu
Forskerhold udvikler bioblæk til at printe terapeutiske midler i 3-DDr. Akhilesh K. Gaharwar, adjunkt ved Institut for Biomedicinsk Teknik, leder et forskningsprojekt for at udvikle en bioink-platform til sekvestrering af terapeutiske proteiner i en 3D-printet struktu -
 Forskere opdager, at trækul fanger ammoniakforureningRachel Hestrin (til højre) på beamlines ved canadian light Source sammen med Cornell-forsker Angela Possinger. Kredit:Canadian Light Source Cornell University-forskerne Rachel Hestrin og Johannes
Forskere opdager, at trækul fanger ammoniakforureningRachel Hestrin (til højre) på beamlines ved canadian light Source sammen med Cornell-forsker Angela Possinger. Kredit:Canadian Light Source Cornell University-forskerne Rachel Hestrin og Johannes -
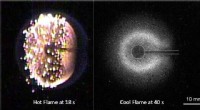 Seje flammer antændte i rummetVarme flammer (venstre) viger for kølige flammer (højre). Kredit:University of Maryland En opdagelse er blevet gjort i Jordens kredsløb - konstante sfæriske kølige diffusionsflammer. Målinger i di
Seje flammer antændte i rummetVarme flammer (venstre) viger for kølige flammer (højre). Kredit:University of Maryland En opdagelse er blevet gjort i Jordens kredsløb - konstante sfæriske kølige diffusionsflammer. Målinger i di
- Hvis Jorden er solen?
- Cypern kæmper for at håndtere affald, mens antallet af turister stiger
- Hvorfor har alkalimetal lav ioniseringsenergi?
- Symptomer alle i dit hoved - eller tarm? Måske lidt af begge dele.
- Groupon kunne være på udkig efter at erhverve Yelp midt i aktionærernes utilfredshed
- Hvordan nye beviser for kønsvendinger hjælper med at vise, hvordan kromosomer opretholdes over evo…


