Hvilken af de følgende reaktioner viser, at dannelse NO2 kræver 33,1 kJ mol?
Sådan finder du ud af den rigtige reaktion:
* Standard siger: Nitrogen (N₂) er en gas ved standardbetingelser, og ilt (O₂) er også en gas.
* entalpi af dannelse: Dette er en positiv værdi (+33,1 kJ/mol), hvilket indikerer, at reaktionen er endoterm (kræver energiindgang).
Den korrekte reaktion er:
1/2 N₂ (g) + O₂ (g) → No₂ (g) ΔH =+33,1 kJ/mol
Forklaring:
* 1/2 N₂ (g): Dette repræsenterer en halv mol nitrogengas, hvilket sikrer, at vi producerer en mol NO₂.
* o₂ (g): Dette repræsenterer en mol iltgas.
* no₂ (g): Dette repræsenterer en mol nitrogengioxidgas, produktet.
* ΔH =+33,1 kJ/mol: Dette indikerer, at reaktionen kræver 33,1 kJ energi til at danne en mol NO₂.
Hvorfor andre muligheder er forkerte:
* Enhver reaktion, der ikke involverer N₂ og O₂ som reaktanter, ville være forkert.
* Enhver reaktion med en negativ ΔH ville repræsentere en eksoterm proces, ikke dannelsen af ingen₂.
* Enhver reaktion, der producerer en anden mængde af ingen₂, ville ikke afspejle den standard entalpi af dannelse.
Sidste artikelHvad er duktiliteten af kulstof?
Næste artikelHar H2O en resonansstruktur?
 Varme artikler
Varme artikler
-
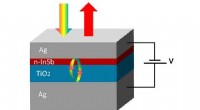 Forskere kommer på forbrugernes bølgelængde med InSb-teknologiSkematisk struktur af en elektrisk indstillelig perfekt lysabsorber. Teknologien til styring af lysabsorption ved udvalgte bølgelængder i nanostrukturer har fået stor opmærksomhed i de senere år;
Forskere kommer på forbrugernes bølgelængde med InSb-teknologiSkematisk struktur af en elektrisk indstillelig perfekt lysabsorber. Teknologien til styring af lysabsorption ved udvalgte bølgelængder i nanostrukturer har fået stor opmærksomhed i de senere år; -
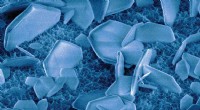 Vand spiller en uventet rolle i dannelsen af mineralerZinkoxidnanopartikler suspenderet i vand klikker sammen, når de er korrekt justeret og danner større krystaller (vist her). Kræfterne mellem partiklerne langs en specifik fastgørelsesretning blev målt
Vand spiller en uventet rolle i dannelsen af mineralerZinkoxidnanopartikler suspenderet i vand klikker sammen, når de er korrekt justeret og danner større krystaller (vist her). Kræfterne mellem partiklerne langs en specifik fastgørelsesretning blev målt -
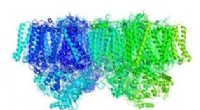 Mekanismen bag de elektriske ladninger genereret af fotosynteseFigur 1. Den båndlignende struktur af fotosystem II-komplekset (PDB ID:3ARC). Kredit:Kobe University Fotosyntese kræver en mekanisme til at producere store mængder kemisk energi uden at miste den
Mekanismen bag de elektriske ladninger genereret af fotosynteseFigur 1. Den båndlignende struktur af fotosystem II-komplekset (PDB ID:3ARC). Kredit:Kobe University Fotosyntese kræver en mekanisme til at producere store mængder kemisk energi uden at miste den -
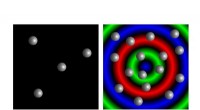 Ny forskning afslører potentiale for syntetiske materialesystemer, der kan tælle og fornemme deres…Modellerede mikrokapsler viser quorum sensing-adfærd. En lille samling mikrokapsler forbliver i dvale (til venstre), mens en stor, overfyldt befolkning udviser svingninger i kemisk aktivitet (til højr
Ny forskning afslører potentiale for syntetiske materialesystemer, der kan tælle og fornemme deres…Modellerede mikrokapsler viser quorum sensing-adfærd. En lille samling mikrokapsler forbliver i dvale (til venstre), mens en stor, overfyldt befolkning udviser svingninger i kemisk aktivitet (til højr
- Neutronspektroskopi afslører, at almindelig iltsvampkatalysator også opsuger brint
- Beskyttelse af indfødte bush-fødevarer og medicin mod biopirateri
- NASA bygger sin næste Mars rover -mission
- Hvorfor Twitter ikke vil forbyde præsident Donald Trump
- Hvilke stoffer er mindre tætte, når de er i solid tilstand, end de flydende tilstand?
- 5-årig tørke rejser spørgsmål om Israels vandstrategi


