Hvad er en sammensat ion?
Her er en sammenbrud:
* kovalent bundet: Atomerne inden for forbindelsesionen holdes sammen af delte elektroner (kovalente bindinger), svarende til hvordan atomer er bundet i molekyler.
* netto elektrisk opladning: Hele gruppen af atomer har en positiv eller negativ ladning på grund af en ubalance i antallet af protoner og elektroner.
Eksempler på sammensatte ioner:
* nitrat (no₃⁻): Et nitrogenatom kovalent bundet til tre iltatomer med en nettoafgift på -1.
* ammonium (nh₄⁺): Et nitrogenatom kovalent bundet til fire hydrogenatomer med en nettoafgift på +1.
* carbonat (co₃²⁻): Et carbonatom kovalent bundet til tre iltatomer med en nettoafgift på -2.
* phosphat (po₄³⁻): Et phosphoratom kovalent bundet til fire iltatomer med en nettoafgift på -3.
Nøglepunkter:
* Forbindelsesioner er vigtige byggesten i mange kemiske forbindelser.
* De er navngivet i henhold til deres specifikke atomer og ladning.
* Ladningen på en sammensat ion bestemmes af antallet af opnåede elektroner eller mistet.
* Forbindelsesioner danner ofte ioniske bindinger med andre ioner for at skabe ioniske forbindelser.
Bemærk: Forbindelsesioner adskiller sig fra enkle ioner, der består af et enkelt atom med et ladning (som na⁺ eller cl⁻).
 Varme artikler
Varme artikler
-
 Forskere udvikler en diagnostisk test, som har til formål at påvise antibiotikaresistens på mindr…Kredit:Medicinsk Forskningsråd Forskere udvikler en lav pris, hurtig diagnostisk sensortest, som har til formål at vise bakteriers modtagelighed for antibiotika inden for 45 minutter. NHS laborat
Forskere udvikler en diagnostisk test, som har til formål at påvise antibiotikaresistens på mindr…Kredit:Medicinsk Forskningsråd Forskere udvikler en lav pris, hurtig diagnostisk sensortest, som har til formål at vise bakteriers modtagelighed for antibiotika inden for 45 minutter. NHS laborat -
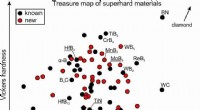 Find alternativer til diamanter til boringDiamant er et af de eneste materialer, der er hårde og seje nok til konstant slibning uden betydelig slid, men diamanter er dyre. Høje omkostninger driver søgen efter nye hårde og superhårde materiale
Find alternativer til diamanter til boringDiamant er et af de eneste materialer, der er hårde og seje nok til konstant slibning uden betydelig slid, men diamanter er dyre. Høje omkostninger driver søgen efter nye hårde og superhårde materiale -
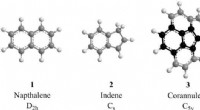 Interstellar kemi:lavtemperaturgasfasedannelse af inden i det interstellare mediumDe enkleste repræsentanter for to-ring PAHer, der bærer to seks-leddede (naphthalen, C10H8; 1) og en seks- sammen med en fem-leddet ring (indene, C9H8; 2). Mens hydrogenabstraktion-vinylacetylen-addit
Interstellar kemi:lavtemperaturgasfasedannelse af inden i det interstellare mediumDe enkleste repræsentanter for to-ring PAHer, der bærer to seks-leddede (naphthalen, C10H8; 1) og en seks- sammen med en fem-leddet ring (indene, C9H8; 2). Mens hydrogenabstraktion-vinylacetylen-addit -
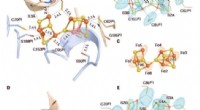 Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A
Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A


