Hvordan påvirker intermolekylære kræfter kogepunktet for en væske?
Forståelse af IMF'er:
* IMF'er er de attraktive kræfter, der findes mellem molekyler. De er svagere end de intramolekylære kræfter, der holder atomer sammen i et molekyle.
* Styrken af IMFS varierer afhængigt af typen af molekyle og dens struktur.
* Der er tre hovedtyper af IMF'er:
* London Dispersion Forces (LDFS): Til stede i alle molekyler stammer de fra midlertidige udsving i elektronfordeling. Dette er de svageste IMF'er.
* dipol-dipol-kræfter: Forekommer mellem polære molekyler, der har permanente dipoler. De er stærkere end LDF'er.
* Hydrogenbinding: En speciel type dipol-dipolinteraktion, der opstår, når et hydrogenatom er bundet til et meget elektronegativt atom (som ilt, nitrogen eller fluor). Dette er de stærkeste IMF'er.
Hvordan IMF'er påvirker kogepunktet:
* stærkere IMFS =højere kogepunkt: Når IMF'er er stærke, kræves der mere energi for at overvinde attraktionerne mellem molekyler og tillader dem at flygte ind i gasfasen. Dette betyder, at der er behov for en højere temperatur for at nå kogepunktet.
* svagere IMFS =lavere kogepunkt: Når IMF'er er svage, er der behov for mindre energi for at adskille molekylerne. Dette resulterer i et lavere kogepunkt.
Eksempler:
* vand (H₂O): Vand har stærk hydrogenbinding på grund af det elektronegative iltatom og hydrogenatomerne. Dette resulterer i et relativt højt kogepunkt (100 ° C).
* methan (ch₄): Metan er et ikke -polært molekyle og har kun svage LDF'er. Dens kogepunkt er meget lavt (-161 ° C).
* ethanol (C₂H₅OH): Ethanol har både LDF'er og hydrogenbinding, hvilket resulterer i et kogepunkt, der er højere end metan, men lavere end vand (78 ° C).
Kortfattet:
Styrken af intermolekylære kræfter er direkte proportional med kogepunktet for en væske. Stærkere IMF'er kræver mere energi til at bryde, hvilket fører til et højere kogepunkt. Omvendt kræver svagere IMF'er mindre energi, hvilket resulterer i et lavere kogepunkt.
Sidste artikelHvad er Bohr-Rutherford-diagrammet for ilt?
Næste artikelHvad er en sammensat ion?
 Varme artikler
Varme artikler
-
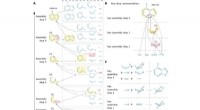 Samlingsteori kan betyde gode nyheder for lægemiddelopdagelseFig. 1. Repræsentationer af en samlingsvej, ved at tage adenin som eksempel. (A) En af adenins mange samlingsveje (det viser sig at være den korteste, ifølge vores MC-algoritme, forklaret senere). Sam
Samlingsteori kan betyde gode nyheder for lægemiddelopdagelseFig. 1. Repræsentationer af en samlingsvej, ved at tage adenin som eksempel. (A) En af adenins mange samlingsveje (det viser sig at være den korteste, ifølge vores MC-algoritme, forklaret senere). Sam -
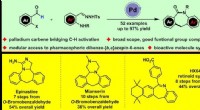 Modulær tilgang til dibenzo-fusionerede ε-lactamer gennem carbene-brodannende CH-aktiveringPalladiumkatalyseret adgang til dibenzo-fusionerede ε-lactamer og applikationen. Kredit:Prof. HUANGs gruppe På grund af deres spændende biologiske aktiviteter og potentielle anvendelighed til at t
Modulær tilgang til dibenzo-fusionerede ε-lactamer gennem carbene-brodannende CH-aktiveringPalladiumkatalyseret adgang til dibenzo-fusionerede ε-lactamer og applikationen. Kredit:Prof. HUANGs gruppe På grund af deres spændende biologiske aktiviteter og potentielle anvendelighed til at t -
 Undersøgelse afslører dannelsesmekanismen for den første carbon-carbon-binding i MTO-processenAfsløring af hele de første C-C-bindingsdannelsesprocesser i MTO-reaktion:baseret på in situ NMR spektroskopiske beviser og avanceret ab initio molekylær dynamik (AIMD) teoretisk beregningsmetode. Kre
Undersøgelse afslører dannelsesmekanismen for den første carbon-carbon-binding i MTO-processenAfsløring af hele de første C-C-bindingsdannelsesprocesser i MTO-reaktion:baseret på in situ NMR spektroskopiske beviser og avanceret ab initio molekylær dynamik (AIMD) teoretisk beregningsmetode. Kre -
 Tethered chem combos kunne revolutionere kunstig fotosynteseKlik på billedet for at downloade en version i høj opløsning.Brookhaven Lab kemiker Javier Concepcion og Lei Wang, en kandidatstuderende ved Stony Brook University, udtænkt et skema til samling af lys
Tethered chem combos kunne revolutionere kunstig fotosynteseKlik på billedet for at downloade en version i høj opløsning.Brookhaven Lab kemiker Javier Concepcion og Lei Wang, en kandidatstuderende ved Stony Brook University, udtænkt et skema til samling af lys
- Hvordan øger du forstørrelseskraften for et teleskop?
- Hvordan en bakteriecelle genkender sit eget DNA
- Hvordan bruges vand til at udnytte energien?
- Klassificeret i forskellige typer elliptisk spiral og spærret vores er Mælkevejen?
- Floddeltaer drukner, truer hundreder af millioner af mennesker
- Hvordan fjernarbejde udgør unikke udfordringer for offentligt ansatte


