C4H10 O2CO2 H2O Hvordan balanserer du dette?
1. Skriv den ubalancerede ligning:
C4H10 + O2 → CO2 + H2O
2. Balance carbonatomerne:
Der er 4 carbonatomer på venstre side (i C4H10) og 1 på højre side (i CO2). Sæt en 4 foran CO2:
C4H10 + O2 → 4CO2 + H2O
3. Balance hydrogenatomerne:
Der er 10 hydrogenatomer på venstre side (i C4H10) og 2 på højre side (i H2O). Sæt en 5 foran H2O:
C4H10 + O2 → 4CO2 + 5H2O
4. Balance oxygenatomerne:
Der er 2 iltatomer på venstre side (i O2) og 13 på højre side (8 fra 4CO2 og 5 fra 5H2O). Sæt en 13/2 foran O2:
C4H10 + 13/2 O2 → 4CO2 + 5H2O
5. Fjern fraktioner (valgfrit):
For at slippe af med brøkdelen skal du multiplicere hele ligningen med 2:
2C4H10 + 13O2 → 8CO2 + 10H2O
afbalanceret ligning:
Den afbalancerede kemiske ligning for forbrænding af butan er:
2C4H10 + 13O2 → 8CO2 + 10H2O
 Varme artikler
Varme artikler
-
 At skabe energi og værdifulde produkter fra frugtaffaldKredit:Pixabay/CC0 Public Domain Affald fra citrusindustrien kan levere biogas og værdifulde produkter til en række industrier. Dette er blevet vist af Lukitawesa, som for nylig forsvarede sin dok
At skabe energi og værdifulde produkter fra frugtaffaldKredit:Pixabay/CC0 Public Domain Affald fra citrusindustrien kan levere biogas og værdifulde produkter til en række industrier. Dette er blevet vist af Lukitawesa, som for nylig forsvarede sin dok -
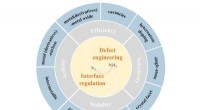 Defekt- og interfaceteknik til e-NRR under omgivelsesbetingelserSkematisk oversigt over defekt- og interfaceteknik til effektiv e-NRR elektrokatalysator. Kredit:Journal of Energy Chemistry Den elektrokemiske nitrogenreduktionsreaktion (e-NRR) under omgivelsesb
Defekt- og interfaceteknik til e-NRR under omgivelsesbetingelserSkematisk oversigt over defekt- og interfaceteknik til effektiv e-NRR elektrokatalysator. Kredit:Journal of Energy Chemistry Den elektrokemiske nitrogenreduktionsreaktion (e-NRR) under omgivelsesb -
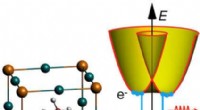 Lyser på rekombinationsmekanismer i solcellematerialerStærk spin-orbit-kobling i halogenidperovskitter inducerer spaltning af båndkanterne, hvilket kan påvirke rekombinationshastigheden. Kredit:X. Zhang og J.-X. Shen Hybride perovskiter er spektakulæ
Lyser på rekombinationsmekanismer i solcellematerialerStærk spin-orbit-kobling i halogenidperovskitter inducerer spaltning af båndkanterne, hvilket kan påvirke rekombinationshastigheden. Kredit:X. Zhang og J.-X. Shen Hybride perovskiter er spektakulæ -
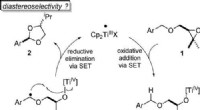 Forskere udvikler en bæredygtig katalyseprocesAtomøkonomisk omdannelse af benzylethere til acetaler ved titanocen(III)-katalyse i enkeltelektrontrin (SET). Angewandte Chemie, DOI:10.1002/anie.202013561 Acetaler er vigtige kemiske forbindelser
Forskere udvikler en bæredygtig katalyseprocesAtomøkonomisk omdannelse af benzylethere til acetaler ved titanocen(III)-katalyse i enkeltelektrontrin (SET). Angewandte Chemie, DOI:10.1002/anie.202013561 Acetaler er vigtige kemiske forbindelser
- Giv mere eksempel på et formbart materiale?
- Hvad er den tidligste måne, der kunne have dannet sig?
- Hvad er en Stars Road til modenhed?
- Simuleringer demonstrerer ionopvarmning ved plasmaoscillationer til fusionsenergi
- Mitsubishi Corp-enhed mister $320 mio. i uautoriserede handler
- Når Kinas forsknings- og udviklingsfinansiering de rigtige virksomheder?


