Hvad sker der med natriums valenselektron, når natriumbindinger med klorform -bordsalt?
* natrium (NA) Har en valenselektron i sin yderste skal. Denne elektron holdes løst og fjernes let.
* klor (Cl) Har syv valenselektroner i sin yderste skal. Den ønsker at få endnu en elektron for at opnå en stabil oktet (8 elektroner).
* ionisk bindingsdannelse: Når natrium og klor reagerer, donerer natrium * dets valenselektron til klor. Dette skaber:
* natriumion (Na+) :Natrium mister en elektron og bliver positivt ladet.
* chloridion (cl-) :Klor får en elektron og bliver negativt ladet.
* Elektrostatisk attraktion: De modsatte ladede ioner (Na+ og Cl-) tiltrækkes derefter af hinanden gennem elektrostatiske kræfter og danner en stærk ionisk binding.
Kortfattet: Natriums valenselektron overføres til klor, hvilket resulterer i dannelsen af positivt ladede natriumioner og negativt ladede chloridioner. Disse ioner tiltrækker derefter hinanden til at danne den stabile, krystallinske struktur af bordsalt.
 Varme artikler
Varme artikler
-
 Bottom-up syntese af krystallinske 2-D polymererKredit:CC0 Public Domain Forskere ved Center for Advancing Electronics Dresden (cfaed) ved TU Dresden er lykkedes med at syntetisere arklignende 2-D-polymerer ved en bottom-up-proces for første ga
Bottom-up syntese af krystallinske 2-D polymererKredit:CC0 Public Domain Forskere ved Center for Advancing Electronics Dresden (cfaed) ved TU Dresden er lykkedes med at syntetisere arklignende 2-D-polymerer ved en bottom-up-proces for første ga -
 En måde at bevidst ændre krumningen af bøjede molekyler ved hjælp af en polymer og ultraviolet…Scanning elektronmikroskopi billede af de kolloidale bananer. Bemærk den falske farve understreger partiklernes form. Skalaen er 5 mikrometer. Kredit:Carla Fernandez-Rico Et team af forskere fra U
En måde at bevidst ændre krumningen af bøjede molekyler ved hjælp af en polymer og ultraviolet…Scanning elektronmikroskopi billede af de kolloidale bananer. Bemærk den falske farve understreger partiklernes form. Skalaen er 5 mikrometer. Kredit:Carla Fernandez-Rico Et team af forskere fra U -
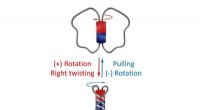 Alle afviklede:En reversibel molekylær hvirvelDenne molekylære hvirvel kan vrides reversibelt, og forskere kan måle dens kræfter. Kredit:Tilpasset fra Journal of the American Chemical Society (2022), DOI:10.1021/jacs.2c02547 I løbet af de sids
Alle afviklede:En reversibel molekylær hvirvelDenne molekylære hvirvel kan vrides reversibelt, og forskere kan måle dens kræfter. Kredit:Tilpasset fra Journal of the American Chemical Society (2022), DOI:10.1021/jacs.2c02547 I løbet af de sids -
 Hvad gør vin tør? Den er nem at smage, men meget sværere at måleEn masse kemi og fysik ligger bag, hvordan du opfatter en tår vin. Kredit:GANNA MARTYSHEVA/Shutterstock.com Når du tager en tår vin til et familiemåltid eller fest, hvad lægger du mærke til? Førs
Hvad gør vin tør? Den er nem at smage, men meget sværere at måleEn masse kemi og fysik ligger bag, hvordan du opfatter en tår vin. Kredit:GANNA MARTYSHEVA/Shutterstock.com Når du tager en tår vin til et familiemåltid eller fest, hvad lægger du mærke til? Førs
- Hvad kalder du specialiserede strukturer i celler?
- Verdens største lavalampeboble under NZ
- Tropisk storm Elsa lander, tager til Georgien
- Barcelona -taxaer strejker, blokere hovedgaden
- Hvorfor foretrækker folk, at de alternative former for energi bruges?
- NASA begynder at tjekke ud af Dellingr-rumfartøjer designet til at forbedre robustheden af CubeSa…


