Hvad vil du se, når du opløses kaliumchlorid med vand?
* opløsning: De ioniske bindinger, der holder kalium (K+) og chlorid (CL-) -ioner sammen i den faste KCL-krystalpause. Vandmolekylerne, der er polære, omgiver ionerne og trækker dem fra hinanden og adskiller dem effektivt fra krystalgitteret.
* Løsning: Kalium- og chloridioner bliver omgivet af vandmolekyler, hvilket danner en homogen blanding (opløsning). Løsningen ser ud til at være klar og farveløs, svarende til rent vand.
Vigtige noter:
* varmeændring: Opløsning af KCL i vand er en endotermisk proces, hvilket betyder, at den absorberer varme fra omgivelserne. Du vil muligvis bemærke en lille køleeffekt, hvis du opløser en stor mængde KCL.
* Intet synligt bundfald: Da kaliumchlorid er meget opløseligt i vand, kan du ikke se noget fast bundfaldsform.
Kort sagt er den mest bemærkelsesværdige ændring, når der opløses KCL i vand, forsvinden af de faste krystaller, hvilket resulterer i en klar, farveløs løsning.
 Varme artikler
Varme artikler
-
 Blod fra stofbrugere kan afsløre stoffets oprindelseMirjam de Bruin-Hoegée udfører en kemisk analyse med LC-Orbitrap-MS. Kredit:University of Amsterdam Opioiden fentanyl bruges ikke kun i medicinsk praksis som smertestillende, men er også et populæ
Blod fra stofbrugere kan afsløre stoffets oprindelseMirjam de Bruin-Hoegée udfører en kemisk analyse med LC-Orbitrap-MS. Kredit:University of Amsterdam Opioiden fentanyl bruges ikke kun i medicinsk praksis som smertestillende, men er også et populæ -
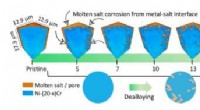 Forskere ser smeltede salte skære små kroge og tunneler ind i metallegeringer i 3DIllustrationen viser, hvordan smeltet salt over tid fjerner metallisk materiale (blå) fra prøven i 3D (øvre) og 2D -visualiseringer (nedre). Denne proces, såkaldt dealloying skaber et bikontinuerligt
Forskere ser smeltede salte skære små kroge og tunneler ind i metallegeringer i 3DIllustrationen viser, hvordan smeltet salt over tid fjerner metallisk materiale (blå) fra prøven i 3D (øvre) og 2D -visualiseringer (nedre). Denne proces, såkaldt dealloying skaber et bikontinuerligt -
 Forskere fandt et alternativ til vandchloreringSpecialister i (SPbPU), udviklet et unikt udstyr til kompleks vandrensning. Kredit:Peter den Store St. Petersborg Polytechnic University Forskere ved Peter den Store St.Petersburg Polytechnic Univ
Forskere fandt et alternativ til vandchloreringSpecialister i (SPbPU), udviklet et unikt udstyr til kompleks vandrensning. Kredit:Peter den Store St. Petersborg Polytechnic University Forskere ved Peter den Store St.Petersburg Polytechnic Univ -
 Nyt materiale kan frigøre potentialet for brintdrevne køretøjerKredit: Energi- og miljøvidenskab (2018). DOI:10.1039/C8EE02499E Forskere har opdaget et nyt materiale, der kunne holde nøglen til at frigøre potentialet i brintdrevne køretøjer. Mens verden ser
Nyt materiale kan frigøre potentialet for brintdrevne køretøjerKredit: Energi- og miljøvidenskab (2018). DOI:10.1039/C8EE02499E Forskere har opdaget et nyt materiale, der kunne holde nøglen til at frigøre potentialet i brintdrevne køretøjer. Mens verden ser
- Nyt mellemprodukt opdaget til fotodissociation af triiodidanion, en klassisk lærebogsreaktion
- Tyske universiteter vil sandsynligvis drage fordel af Brexit, rapporten foreslår
- Er frekvensen af firkantbølge lig med baudhastigheden?
- Første 3D-printede protonledende membran baner vej for skræddersyede energilagringsenheder
- Hvad er koncentrationen af molekyler lige gennem rummet?
- Nye spor af Zanclean-megafloden fundet i Alboranhavet


