Hvilken kemisk binding i molekylet af chlormethan er mere polær carbon-chlor eller kulstof-hydrogenbinding?
* Elektronegativitet: Klor er meget mere elektronegativ end kulstof og brint. Dette betyder, at klor har et stærkere træk på de delte elektroner i bindingen.
* Polaritet: Den ulige deling af elektroner i carbon-chlorbindingen skaber en delvis negativ ladning (Δ-) på kloratomet og en delvis positiv ladning (Δ+) på carbonatomet. Dette skaber et dipolmoment i bindingen, hvilket gør det polært.
* kulstof-hydrogenbinding: Mens der er en lille forskel i elektronegativitet mellem kulstof og brint, er det meget mindre sammenlignet med forskellen mellem kulstof og klor. Dette resulterer i et meget svagere dipolmoment, hvilket gør kulstof-hydrogenbindingen mindre polær.
Kortfattet: Den større elektronegativitetsforskel mellem klor og kulstof fører til en mere polær carbon-chlorbinding i chlormethan.
 Varme artikler
Varme artikler
-
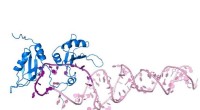 Ny indsigt i modning af miRNA'erForfatterne var i stand til at vise nøjagtigt, hvordan et specifikt RNA-bindende protein (blåt) genkender pri-miR-18a (pink) og ændrer dets struktur på en sådan måde, at det udvikler sig til modent mi
Ny indsigt i modning af miRNA'erForfatterne var i stand til at vise nøjagtigt, hvordan et specifikt RNA-bindende protein (blåt) genkender pri-miR-18a (pink) og ændrer dets struktur på en sådan måde, at det udvikler sig til modent mi -
 Undersøgelse finder beviser for eksistensen af undvigende metabolonKredit:CC0 Public Domain I mere end 40 år, videnskabsmænd har antaget eksistensen af enzymklynger, eller metaboloner, ved at lette forskellige processer i celler. Ved hjælp af en ny billedtekno
Undersøgelse finder beviser for eksistensen af undvigende metabolonKredit:CC0 Public Domain I mere end 40 år, videnskabsmænd har antaget eksistensen af enzymklynger, eller metaboloner, ved at lette forskellige processer i celler. Ved hjælp af en ny billedtekno -
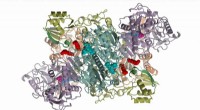 Molekylært maskineri, der fremstiller potent antibiotika, afsløret efter årtiers forskning3D-strukturen af McbBCD, et enzym (protein), der laver det potente antibiotikum mikrocin B17 fra et mindre protein kendt som et peptid, som afsløret ved røntgenkrystallografi. De røde kugler viser k
Molekylært maskineri, der fremstiller potent antibiotika, afsløret efter årtiers forskning3D-strukturen af McbBCD, et enzym (protein), der laver det potente antibiotikum mikrocin B17 fra et mindre protein kendt som et peptid, som afsløret ved røntgenkrystallografi. De røde kugler viser k -
 Ny inkjet-udskrivningsmetode kunne fremskynde opdagelse af lægemidler og trykt personlig lægemidde…Tomme porer synlige i en polymerfilm, hvor dråber blev trykt, fanget og frigivet. Kredit:University of Cambridge Cambridge-ingeniører har demonstreret - for første gang - den digitale inkjet-print
Ny inkjet-udskrivningsmetode kunne fremskynde opdagelse af lægemidler og trykt personlig lægemidde…Tomme porer synlige i en polymerfilm, hvor dråber blev trykt, fanget og frigivet. Kredit:University of Cambridge Cambridge-ingeniører har demonstreret - for første gang - den digitale inkjet-print
- Har to proteiner, der har lignende aminosyresekvensfunktioner, selvom de er isoleret fra forskellige…
- Nu eller senere? Forbrugerproduktevaluering afhænger af købstidspunktet
- Poo-poser og trackers:Nepal bestiller nye Everest-regler
- En ladet partikel, der indeholder mere end et atom?
- Forskere opdager, hvordan rapamycin bremser cellevækst
- Den nederste kant af dykkerpladen smelter i varmen fra?


