Hvorfor er det lettere at fjerne et elektron fra et natriumatom end magnesiumatom?
* Elektronkonfiguration:
* natrium (NA): 1S² 2S² 2P⁶ 3S¹
* magnesium (mg): 1S² 2S² 2P⁶ 3S²
* Natrium har et elektron i sin yderste skal (3S), mens magnesium har to.
* ioniseringsenergi: Den energi, der kræves for at fjerne et elektron fra et atom, kaldes ioniseringsenergi. Jo lavere ioniseringsenergi, jo lettere er det at fjerne en elektron.
* stabilitet af ioner:
* natriumion (NA⁺): 1S² 2S² 2P⁶ (stabil ædelgaskonfiguration som neon)
* magnesiumion (mg²⁺): 1S² 2S² 2P⁶ (stabil ædelgaskonfiguration som neon)
Her er sammenbruddet:
1. natrium (NA) mister en elektron for at blive na⁺. Dette resulterer i en fyldt ydre skal, hvilket gør ionen meget stabil. Det opnår den stabile elektronkonfiguration af neon.
2. magnesium (Mg) mister to elektroner for at blive Mg²⁺. Mens den også resulterer i en fyldt ydre skal, er den anden ioniseringsenergi for magnesium meget højere end den første. Dette skyldes, at fjernelse af den anden elektron forstyrrer den stabile 3S² -konfiguration, hvilket gør det sværere at fjerne.
Kortfattet:
* Natrium har en lavere første ioniseringsenergi end magnesium, fordi det er lettere at fjerne et enkelt elektron for at opnå en stabil ædelgaskonfiguration.
* Magnesium har en højere første ioniseringsenergi, fordi det kræver mere energi for at fjerne det første elektron. Selvom det bliver mere stabilt efter at have mistet begge elektroner, er den anden ioniseringsenergi markant højere på grund af forstyrrelsen af den oprindeligt stabile konfiguration.
 Varme artikler
Varme artikler
-
 Detronisering af elektrokatalysatorer til brintproduktion med billigt alternativt materialeElektrokemisk vandopdeling kræver meget aktiv, let fremstillet, og omkostningseffektive elektrokatalysatorer til oxygenudviklingsreaktionen (OER). Et jern (Fe)/calcium (Ca)-baseret bimetaloxid, Cafe
Detronisering af elektrokatalysatorer til brintproduktion med billigt alternativt materialeElektrokemisk vandopdeling kræver meget aktiv, let fremstillet, og omkostningseffektive elektrokatalysatorer til oxygenudviklingsreaktionen (OER). Et jern (Fe)/calcium (Ca)-baseret bimetaloxid, Cafe -
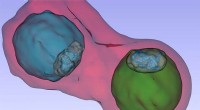 Malariapatogen under røntgenmikroskopetDetaljer såsom parasitternes vakuol (farvet i blåt og grønt) inde i en inficeret blodcelle. Kredit:S. Kapishnikov Malaria er en af de mest truende infektionssygdomme i verden. Et internationalt
Malariapatogen under røntgenmikroskopetDetaljer såsom parasitternes vakuol (farvet i blåt og grønt) inde i en inficeret blodcelle. Kredit:S. Kapishnikov Malaria er en af de mest truende infektionssygdomme i verden. Et internationalt -
 Forskere opdager en ny klasse af halvledende entropistabiliserede materialerKrystalstruktur af GeSnPbSSeTe, en halvledende entropistabiliseret chalcogenidlegering. De gule atomer er kationer (Ge, Sn, Pb) og de blå atomer er anioner (S, Se, Te). Forskellen i lethed svarer til
Forskere opdager en ny klasse af halvledende entropistabiliserede materialerKrystalstruktur af GeSnPbSSeTe, en halvledende entropistabiliseret chalcogenidlegering. De gule atomer er kationer (Ge, Sn, Pb) og de blå atomer er anioner (S, Se, Te). Forskellen i lethed svarer til -
 Kolloidale gelegenskaber under mikroskopetKredit:CC0 Public Domain Forskere ved University of Tokyo har udtænkt en metode til at følge gelering af kolloidale geler. Deres konfokalmikroskopiteknik har gjort det muligt at analysere de forsk
Kolloidale gelegenskaber under mikroskopetKredit:CC0 Public Domain Forskere ved University of Tokyo har udtænkt en metode til at følge gelering af kolloidale geler. Deres konfokalmikroskopiteknik har gjort det muligt at analysere de forsk
- Er brom et fast stof ved 7 grader celsius?
- Teknikken tillader praktisk, præcis optisk billeddannelse af individuelle proteiner
- Hvad er de fire grundlæggende naturkræfter?
- Visualisering af molekylære fodbolde
- Sådan beregnes lyspolebasestørrelse
- Avanceret billedbehandlingsteknik kaster lys over, hvordan DNA-strenge stables op


