Hvorfor natriummetal er mere reaktiv end magnesiummetal?
* atomradius: Natrium har en større atomradius end magnesium. Dette betyder, at dets yderste elektron er længere væk fra kernen og oplever svagere tiltrækning. Som et resultat er det lettere at fjerne dette elektron, hvilket gør natrium lettere oxideret.
* ioniseringsenergi: Natrium har en lavere ioniseringsenergi end magnesium. Dette betyder, at det kræver mindre energi for at fjerne et elektron fra et natriumatom, hvilket gør det mere sandsynligt at miste en elektron og blive en kation.
* Elektronegativitet: Natrium har en lavere elektronegativitet end magnesium. Dette betyder, at det har en svagere attraktion for elektroner og er mere tilbøjelige til at donere elektroner i en kemisk reaktion.
i enklere termer: Natriums større størrelse og svagere hold på dets yderste elektron gør det mere reaktivt end magnesium. Det er lettere for natrium at miste en elektron og danne en positiv ion, som er grundlaget for dens reaktivitet.
Her er en nyttig analogi:Forestil dig en ballon. En større ballon (natrium) er lettere at sprænge end en mindre ballon (magnesium), fordi trykket på dens overflade er mindre. Tilsvarende betyder Sodiums større størrelse, at dets yderste elektron er mindre tæt bundet, hvilket gør det lettere at "sprænge" og blive reaktiv.
 Varme artikler
Varme artikler
-
 Nyt bevis indsendt til Grenfell Tower Inquiry om beklædningsreaktivitetKredit:University of Reading En kemiker fra University of Reading har skrevet til Grenfell Tower Inquiry efter kemiske tests på aluminiumsbeklædningspaneler, udført til et BBC-aktualitetsprogram.
Nyt bevis indsendt til Grenfell Tower Inquiry om beklædningsreaktivitetKredit:University of Reading En kemiker fra University of Reading har skrevet til Grenfell Tower Inquiry efter kemiske tests på aluminiumsbeklædningspaneler, udført til et BBC-aktualitetsprogram. -
 Hvordan en optisk pincet kunne løse en af kriminallaboratoriets største udfordringerJoseph Reiner, Ph.D., en lektor ved Institut for Fysik, og Michael Valle, en kandidatstuderende på Institut for Retsvidenskab, betjene en optisk pincet til at adskille celler i en retsmedicinsk prøve.
Hvordan en optisk pincet kunne løse en af kriminallaboratoriets største udfordringerJoseph Reiner, Ph.D., en lektor ved Institut for Fysik, og Michael Valle, en kandidatstuderende på Institut for Retsvidenskab, betjene en optisk pincet til at adskille celler i en retsmedicinsk prøve. -
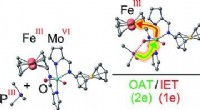 Bioinspireret enzymmodel med redox -switchKredit:Wiley Koblede oxygenoverførsler og elektronoverførselsreaktioner, der anvender kofaktorer, er enzymatiske reaktioner af afgørende betydning for alle livsformer fra bakterier til hvirveldyr.
Bioinspireret enzymmodel med redox -switchKredit:Wiley Koblede oxygenoverførsler og elektronoverførselsreaktioner, der anvender kofaktorer, er enzymatiske reaktioner af afgørende betydning for alle livsformer fra bakterier til hvirveldyr. -
 For renere luft, vand, og jordGiftige kemikalier har ingen chance mod et nanoskjold skabt af forskere fra IPC PAS. Foto taget på stedet af Front Modlin-firmaet. Kredit:IPC PAS, Grzegorz Krzyzewski Luften omkring os bliver mere
For renere luft, vand, og jordGiftige kemikalier har ingen chance mod et nanoskjold skabt af forskere fra IPC PAS. Foto taget på stedet af Front Modlin-firmaet. Kredit:IPC PAS, Grzegorz Krzyzewski Luften omkring os bliver mere
- VLBA finder planeten i kredsløb lille, cool stjerne
- Kontorstress? Arbejdere kan vente, før de handler ud, viser undersøgelse
- Hvordan er Big Bang -teorien baseret på observationer?
- Hvad er en sætning, du kunne bruge ordet Lunar?
- Hvor mange måner har Tres 4 planeten?
- Hvad er det sammensatte navn på HG2 NO3 2?


