Har alle oxidationsreduktionsreaktioner til fælles?
* overførsel af elektroner: Kernen i en redoxreaktion er overførsel af elektroner fra en art til en anden.
* Ændring i oxidationstilstande: De arter, der mister elektroner (oxidation), oplever en stigning i oxidationstilstand, mens de arter, der får elektroner (reduktion), oplever et fald i oxidationstilstand.
* Samtidig oxidation og reduktion: Oxidation og reduktion forekommer altid samtidig. Du kan ikke have den ene uden den anden.
* bevarelse af gebyr: Den samlede ladning før og efter reaktionen forbliver konstant.
Lad os nedbryde betingelserne:
* Oxidation: Tab af elektroner, stigning i oxidationstilstand.
* reduktion: Gevinst af elektroner, fald i oxidationstilstand.
* Oxideringsmiddel: De arter, der får en anden art til at blive oxideret (i sig selv bliver reduceret).
* reduktionsmiddel: De arter, der får en anden art til at blive reduceret (i sig selv bliver oxideret).
Key Takeaway: Redox -reaktioner handler om bevægelse af elektroner, der forårsager ændringer i oxidationstilstande og fører til dannelse af nye produkter.
 Varme artikler
Varme artikler
-
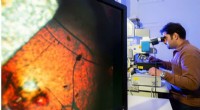 Smeltende glas fra usmeltelige forbindelserVahid Nozari ved University of Jena bruger et mikroskop til at undersøge det nye syntetiske glas, som består af en ikke-smeltbar metal-organisk rammeforbindelse (MOF). Kredit:Jens Meyer/University of
Smeltende glas fra usmeltelige forbindelserVahid Nozari ved University of Jena bruger et mikroskop til at undersøge det nye syntetiske glas, som består af en ikke-smeltbar metal-organisk rammeforbindelse (MOF). Kredit:Jens Meyer/University of -
 Forskere udvikler nye, hurtig pipeline for antimikrobielle stofferASU-forskere har for nylig mødt en udfordring med at udvikle en ny klasse af antimikrobielle stoffer, kaldet synbodies, at beskytte befolkningen mod smitsomme trusler - alt sammen inden for en uge. Kr
Forskere udvikler nye, hurtig pipeline for antimikrobielle stofferASU-forskere har for nylig mødt en udfordring med at udvikle en ny klasse af antimikrobielle stoffer, kaldet synbodies, at beskytte befolkningen mod smitsomme trusler - alt sammen inden for en uge. Kr -
 Stigningen, fald og genopblussen af genterapiKredit:CC0 Public Domain For tyve år siden, videnskabsmænd og investorer var svimlende over løftet om genterapi for at helbrede en lang række dødelige sygdomme. Men en ung mands tragiske død efter
Stigningen, fald og genopblussen af genterapiKredit:CC0 Public Domain For tyve år siden, videnskabsmænd og investorer var svimlende over løftet om genterapi for at helbrede en lang række dødelige sygdomme. Men en ung mands tragiske død efter -
 Tilsæt bare vand:Enkelt trin øger polymerers evne til at filtrere kuldioxid fra blandede gasserKredit:NC State Et internationalt team af forskere har fundet ud af, at det kan øge en eksisterende polymers evne til selektivt at fjerne kuldioxid (CO 2 ) ud af gasblandinger ved først at nedsæ
Tilsæt bare vand:Enkelt trin øger polymerers evne til at filtrere kuldioxid fra blandede gasserKredit:NC State Et internationalt team af forskere har fundet ud af, at det kan øge en eksisterende polymers evne til selektivt at fjerne kuldioxid (CO 2 ) ud af gasblandinger ved først at nedsæ
- Vær ydmyg for at få succes på arbejdspladsen, siger undersøgelse
- Hvad er metalstruktur, der gør dem lette at forme?
- Hvorfor er det farligt at se på en solformørkelse?
- Uventet synder - vådområder som kilde til metan
- Hvilken planet er den sidste rigtige i dit solsystem?
- Hvad hvis du har Saturn på 27 grader Aquarius og Moon Libra?


