Skriv en kemisk ligning, der angiver, hvordan OH opfører sig som en base i flydende ammoniak?
OH⁻ (L) + NH₃ (L) ⇌ NH₂⁻ (L) + H₂O (L)
Forklaring:
* oh⁻ (l) :Hydroxidion i flydende ammoniak.
* nh₃ (l) :Flydende ammoniak, der fungerer som et opløsningsmiddel og en svag syre.
* nh₂⁻ (l) :Amidion, den konjugatbase af ammoniak, dannet ved fjernelse af en proton (H⁺).
* h₂o (l) :Vand, dannet af kombinationen af protonen fjernet fra ammoniak og hydroxidion.
mekanisme:
Hydroxidion, der er en stærk base i flydende ammoniak, accepterer let en proton fra ammoniak. Dette resulterer i dannelsen af amidionen (NH₂⁻), en stærkere base end ammoniak og vand. Denne reaktion fremhæver Brønsted-Lowry-definitionen af syrer og baser, hvor en base accepterer en proton.
Bemærk: Denne reaktion ligger stærkt til højre, hvilket indikerer, at hydroxidionen er en stærk base i flydende ammoniak og reagerer let for at danne amidion.
 Varme artikler
Varme artikler
-
 Brug af vandmolekyler til at aflæse elektrisk aktivitet i lipidmembranerEPFL-forskere var i stand til i realtid at kortlægge, hvordan ladninger transporteres over og langs membraner, blot ved at observere adfærden af tilstødende vandmolekyler. Kredit:Jamani Caillet/EPFL
Brug af vandmolekyler til at aflæse elektrisk aktivitet i lipidmembranerEPFL-forskere var i stand til i realtid at kortlægge, hvordan ladninger transporteres over og langs membraner, blot ved at observere adfærden af tilstødende vandmolekyler. Kredit:Jamani Caillet/EPFL -
 Historien bag uendeligt genanvendeligt plastikBerkeley Lab-forskerne Brett Helms (til venstre) og Corinne Scown holder prøver af PDK-plastik, et unikt nyt materiale, der kan genbruges i det uendelige - en stor forbedring i forhold til traditionel
Historien bag uendeligt genanvendeligt plastikBerkeley Lab-forskerne Brett Helms (til venstre) og Corinne Scown holder prøver af PDK-plastik, et unikt nyt materiale, der kan genbruges i det uendelige - en stor forbedring i forhold til traditionel -
 Madlavningskemi minus varme er lig med ny ikke-giftig klæbemiddelDet naturlige klæbemiddel skabt af muslinger for at klæbe til hinanden og undervandsoverflader har inspireret til en ny giftfri lim. Kredit:Jonathan Wilker/Purdue Det ser ud til, at kagerne, der e
Madlavningskemi minus varme er lig med ny ikke-giftig klæbemiddelDet naturlige klæbemiddel skabt af muslinger for at klæbe til hinanden og undervandsoverflader har inspireret til en ny giftfri lim. Kredit:Jonathan Wilker/Purdue Det ser ud til, at kagerne, der e -
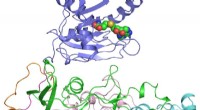 Forskere knækker strukturen af nøgleprotein i Zika-virusKrystalstrukturen af ZIKV NS5-protein. Regionerne med forskellige farver repræsenterer individuelle domæner eller motiver af ZIKV NS5. Den sorte cirkel markerer placeringen af det potentielle inhi
Forskere knækker strukturen af nøgleprotein i Zika-virusKrystalstrukturen af ZIKV NS5-protein. Regionerne med forskellige farver repræsenterer individuelle domæner eller motiver af ZIKV NS5. Den sorte cirkel markerer placeringen af det potentielle inhi


