Hvordan tilberedes brint i laboratoriet?
1. Reaktion af et metal med fortyndet syre:
* Materialer:
* Fortynd saltsyre (HCI) eller fortyndet svovlsyre (H₂so₄)
* Zinkgranuler (Zn) eller magnesiumbånd (MG)
* En konisk kolbe eller et reagensglas
* Leveringsrør
* En gaskrukke eller bægerglas fyldt med vand (for at opsamle brintgas)
* Procedure:
1. Placer metallet (Zn eller Mg) i kolben.
2. Tilsæt fortyndet syre.
3. reaktionen vil producere brintgas.
4. opsaml brintgassen ved forskydning af vand.
* Kemisk ligning:
* Zn (S) + 2HCl (aq) → Zncl₂ (aq) + H₂ (g)
* Mg (s) + H₂so₄ (aq) → mgso₄ (aq) + h₂ (g)
2. Reaktion af natrium med vand:
* Materialer:
* Natriummetal (NA)
* Vand (H₂O)
* En petriskål
* En gaskrukke eller bægerglas fyldt med vand (for at opsamle brintgas)
* Procedure:
1. Placer forsigtigt et lille stykke natriummetal i petriskålen.
2. Tilsæt et par dråber vand.
3. reaktionen vil være kraftig og producere brintgas og varme.
4. opsaml brintgassen ved forskydning af vand.
* Kemisk ligning:
* 2NA (S) + 2H₂O (L) → 2NAOH (AQ) + H₂ (G)
3. Elektrolyse af vand:
* Materialer:
* Vand (H₂O)
* To elektroder (f.eks. Grafitstænger)
* Et batteri eller strømforsyning
* Et bægerglas
* To testrør fyldt med vand (for at opsamle gasserne)
* Procedure:
1. Udfyld bægerglas med vand.
2. Tilslut elektroderne til batteriet eller strømforsyningen.
3. Undersænk elektroderne i vandet.
4. tænd for strømforsyningen.
5. Hydrogengas vil blive produceret ved den negative elektrode (katode) og iltgas ved den positive elektrode (anode).
6. Saml gasserne i reagensglasene.
* Kemisk ligning:
* 2H₂O (L) → 2H₂ (G) + O₂ (G)
Sikkerhedsforholdsregler:
* Bær altid beskyttelsesbriller for at beskytte dine øjne.
* Arbejd i et godt ventileret område.
* Håndter syrer og natriummetal med omhu.
* Indsaml ikke brintgas i en lukket beholder, da den kan være eksplosiv.
Bemærk: Valget af metode afhænger af de tilgængelige materialer og den ønskede renhed af brintgassen. Reaktionen af metaller med syrer er den mest almindelige metode til laboratorieforberedelse.
 Varme artikler
Varme artikler
-
 Forskere udvikler antibakteriel gelbandage ved hjælp af durian-skallerForskellige størrelser af det durian-afledte hydrogelplaster, hvor den kan gøres stor til operationssår eller klippes mindre til typisk bandagestørrelse. Kredit:Nanyang Technological University Fø
Forskere udvikler antibakteriel gelbandage ved hjælp af durian-skallerForskellige størrelser af det durian-afledte hydrogelplaster, hvor den kan gøres stor til operationssår eller klippes mindre til typisk bandagestørrelse. Kredit:Nanyang Technological University Fø -
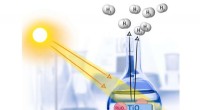 Kemikere tester en ny nanokatalysator til at opnå brintKemikerne overvågede indflydelsen af en titanium-dioxid baseret ruthenium nanokatalysator på emissionen af brint fra en methanol-vand blanding. Kredit:Allen Dressen En kemiker fra RUDN var den
Kemikere tester en ny nanokatalysator til at opnå brintKemikerne overvågede indflydelsen af en titanium-dioxid baseret ruthenium nanokatalysator på emissionen af brint fra en methanol-vand blanding. Kredit:Allen Dressen En kemiker fra RUDN var den -
 Bærbar biosensor advarer mod hjerteanfald og slagtilfældeDen bærbare måleenhed med USB -interface til tilslutning til bærbar computer. Softwaren installeret i bærbar computer giver GUI til at styre måleparametre og vise testresultaterne. Indsæt viser den em
Bærbar biosensor advarer mod hjerteanfald og slagtilfældeDen bærbare måleenhed med USB -interface til tilslutning til bærbar computer. Softwaren installeret i bærbar computer giver GUI til at styre måleparametre og vise testresultaterne. Indsæt viser den em -
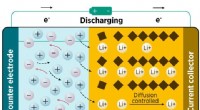 Røntgenanalyse afslører opladningsmekanismen for et lovende elektrodematerialeEn titaniumdioxidelektrode optager lithiumioner, når batteriet aflades. Kredit:Ref. 1. © 2018 Wiley-VCH Verlag GmbH &Co. KGaA, Weinheim En eksperimentel teknik udviklet af A*STAR-forskere er bleve
Røntgenanalyse afslører opladningsmekanismen for et lovende elektrodematerialeEn titaniumdioxidelektrode optager lithiumioner, når batteriet aflades. Kredit:Ref. 1. © 2018 Wiley-VCH Verlag GmbH &Co. KGaA, Weinheim En eksperimentel teknik udviklet af A*STAR-forskere er bleve


