Hvad er tætheden af svovldioxidgas SO2 ved 475 mm Hg og 58,5C?
1. Konverter enheder
* tryk: Konverter millimeter af Mercury (MMHG) til atmosfærer (ATM):
475 mmHg * (1 atm / 760 mmHg) =0,625 atm
* Temperatur: Konverter Celsius (° C) til Kelvin (K):
58,5 ° C + 273,15 =331,65 K
2. Brug den ideelle gaslov
Den ideelle gaslov er:PV =NRT
Hvor:
* P =pres (ATM)
* V =volumen (l)
* n =antal mol
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (k)
Vi kan omarrangere denne ligning for at løse for densitet (ρ), som er masse (m) pr. Enhedsvolumen (v):
ρ =m / v =(n * m) / v
Hvor m er den molære masse af SO2 (64,06 g/mol).
Udskift den ideelle gaslov i densitetsligningen:
ρ =(p * m) / (r * t)
3. Tilslut værdierne
ρ =(0,625 atm * 64,06 g/mol)/(0,0821 l · atm/mol · K * 331,65 K)
4. Beregn tætheden
ρ ≈ 1,46 g/l
Derfor er densiteten af svovldioxidgas ved 475 mmHg og 58,5 ° C ca. 1,46 g/l.
Sidste artikelHvordan fungerer kvaternære ammoniumforbindelser?
Næste artikelHvad er de tre hovedgrupper af kulbrinter?
 Varme artikler
Varme artikler
-
 Team fremstiller magneter udelukkende af sjældne jordarter fra USACMI-forsker Ikenna Nlebedim har prøver af neodym-jern-bor-magneter, der er hentet og fremstillet udelukkende i USA. Evnen til at producere sjældne jordarters magneter på hjemmemarkedet kunne give posi
Team fremstiller magneter udelukkende af sjældne jordarter fra USACMI-forsker Ikenna Nlebedim har prøver af neodym-jern-bor-magneter, der er hentet og fremstillet udelukkende i USA. Evnen til at producere sjældne jordarters magneter på hjemmemarkedet kunne give posi -
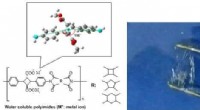 Højtermoresistente biopolyimider bliver vandopløselige som stivelseStrukturer af vandopløselige biopolyimider afledt af 4, 4-diaminotruxillinsyresalt med let bøjet struktur (model i toppen) og forskellige dianhydrider (venstre strukturer). Vandopløsende adfærd (højre
Højtermoresistente biopolyimider bliver vandopløselige som stivelseStrukturer af vandopløselige biopolyimider afledt af 4, 4-diaminotruxillinsyresalt med let bøjet struktur (model i toppen) og forskellige dianhydrider (venstre strukturer). Vandopløsende adfærd (højre -
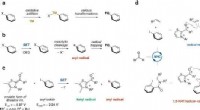 Arylradikaldannelse ved arylhalogenidbindingsspaltning med en N-heterocyklisk carbenkatalysatora Oxidativ tilsætning af arylhalogenid til overgangsmetal. TM, overgangsmetal. b Organisk elektrondonor-induceret generering af arylradikal (nylig fremgang). SÆT, enkelt elektronoverførsel. OED, organ
Arylradikaldannelse ved arylhalogenidbindingsspaltning med en N-heterocyklisk carbenkatalysatora Oxidativ tilsætning af arylhalogenid til overgangsmetal. TM, overgangsmetal. b Organisk elektrondonor-induceret generering af arylradikal (nylig fremgang). SÆT, enkelt elektronoverførsel. OED, organ -
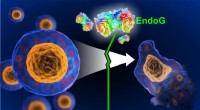 Biokemikere opdager et enzym til at stoppe celledødKredit:RUDN Universitet RUDN biokemikere fandt ud af, at apoptose (programmeret celledød) kan reguleres ved hjælp af EndoG -enzymet. Opdagelsen vil føre til en bedre forståelse af celle- og vævsbe
Biokemikere opdager et enzym til at stoppe celledødKredit:RUDN Universitet RUDN biokemikere fandt ud af, at apoptose (programmeret celledød) kan reguleres ved hjælp af EndoG -enzymet. Opdagelsen vil føre til en bedre forståelse af celle- og vævsbe
- Energi frigøres for celler, der skal bruges, når bindingen mellem to fosfatmolekyler brudt i et su…
- Magnetiske felter ved krydset
- Hvilke faktorer hjælper med at bestemme typen af jord, såsom tykkelseslag og deres sammensætnin…
- Udvidelse af DNA-alfabetet lader celler producere nye proteiner
- Sådan virker elektromagneter
- Hvad er formlen for oprenset vand?


