Hvad er kogepunktet for en 2,86 m opløsningsammoniumnitrat NH4NO3 Antag, at opløsningsmiddelvand, der har Kb 0,51ºC og 100,0ºC?
forståelse af koncepterne
* kogepunkthøjde: Tilsætning af et opløst stof (som ammoniumnitrat) til et opløsningsmiddel (som vand) hæver opløsningens kogepunkt. Dette kaldes kogepunkthøjde.
* molalitet (m): Molalitet er et mål for koncentration udtrykt som mol opløst stof pr. Kg opløsningsmiddel.
* kogepunktstigning konstant (KB): Dette er en egenskab ved opløsningsmidlet, der angiver, hvor meget kogepunktet vil stige for en 1 molal opløsning.
Beregninger
1. Bestem ændringen i kogepunkt (ΔTB):
* ΔTb =kb * Molalitet
* ΔTB =0,51 ° C/m * 2,86 m
* ΔTB =1,46 ° C
2. Beregn det nye kogepunkt:
* Nyt kogepunkt =normalt kogepunkt af vand + ΔTB
* Nyt kogepunkt =100,0 ° C + 1,46 ° C
* nyt kogepunkt =101,46 ° C
Derfor er kogepunktet for en 2,86 m opløsning af ammoniumnitrat i vand 101,46 ° C.
 Varme artikler
Varme artikler
-
 Stærke kunstige kulfibermuskler kan løfte 12, 600 gange deres egen vægtZoom ind på den kulfiberforstærkede oprullede muskel med en diameter på 0,4 mm. Kredit:University of Illinois Department of Mechanical Science and Engineering Optrækket, en øvelse frygtet af de fl
Stærke kunstige kulfibermuskler kan løfte 12, 600 gange deres egen vægtZoom ind på den kulfiberforstærkede oprullede muskel med en diameter på 0,4 mm. Kredit:University of Illinois Department of Mechanical Science and Engineering Optrækket, en øvelse frygtet af de fl -
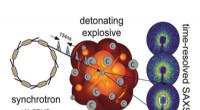 De første amerikanske eksperimenter nogensinde på et nyt røntgenanlæg kan føre til bedre eksplo…Detonationen af kulstofrige højsprængstoffer giver fast kulstof som en hovedbestanddel af produktblandingen, og afhængigt af de termodynamiske forhold bag stødfronten, en række carbonallotroper og -
De første amerikanske eksperimenter nogensinde på et nyt røntgenanlæg kan føre til bedre eksplo…Detonationen af kulstofrige højsprængstoffer giver fast kulstof som en hovedbestanddel af produktblandingen, og afhængigt af de termodynamiske forhold bag stødfronten, en række carbonallotroper og - -
 Nyt kvantemateriale kan advare om neurologisk sygdomDet sorte rektangel under disse guldtrin er et nyt kvantemateriale, der er i stand til at lytte til hjernen ved at gribe atomer, som hjernen naturligt bruger til at kommunikere. Kredit:Purdue Universi
Nyt kvantemateriale kan advare om neurologisk sygdomDet sorte rektangel under disse guldtrin er et nyt kvantemateriale, der er i stand til at lytte til hjernen ved at gribe atomer, som hjernen naturligt bruger til at kommunikere. Kredit:Purdue Universi -
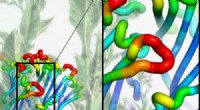 Accelereret opdagelseshastighed kan føre til mere effektive hjælpemidler til rygestopNikotinreceptorer i hjernen er ansvarlige for nikotinafhængighed blandt andre neurologiske roller i CNS. Billedet til venstre viser den komplette receptor, mens det indsatte viser kommunikationsvejen
Accelereret opdagelseshastighed kan føre til mere effektive hjælpemidler til rygestopNikotinreceptorer i hjernen er ansvarlige for nikotinafhængighed blandt andre neurologiske roller i CNS. Billedet til venstre viser den komplette receptor, mens det indsatte viser kommunikationsvejen
- Er geotermisk energi et fossilt brændstof?
- Undersøgelse finder skævhed i postdoc ansættelser
- Hvad er den længste stjerne i Galaxy, der er blevet set fra Jorden, og hvor mange lysår væk?
- Hvordan man identificerer metamorfe klipper
- Definition af hydrauliske og pneumatiske systemer
- Gamle artefakter vendte tilbage til Iran fra amerikansk universitet


