Hvordan binder kaliumchloridpartikler sig til vandpartikler?
1. Ion-dipol-interaktioner:
* KCL er en ionisk forbindelse: Det findes som et gitter af positivt ladede kaliumioner (K+) og negativt ladede chloridioner (Cl-).
* vand er et polært molekyle: Det har en lidt positiv ende (brintside) og en lidt negativ ende (iltside) på grund af den ulige deling af elektroner.
* attraktion: De positive kaliumioner (K+) tiltrækkes af den negative ende af vandmolekyler (ilt -side). Tilsvarende tiltrækkes de negative chloridioner (Cl-) af den positive ende af vandmolekyler (hydrogenside).
2. Hydratiseringsskal:
* omkring ionerne: Vandmolekyler omgiver kalium- og chloridioner og danner en hydratiseringsskal omkring hver ion.
* Elektrostatiske interaktioner: Disse interaktioner er primært elektrostatiske, med de positive og negative ladninger, der tiltrækker hinanden.
* stabilitet: Hydratiseringsskallen hjælper med at stabilisere ionerne i opløsningen og forhindrer dem i at danne krystalgitteret igen.
3. Opløsningsproces:
* Breaking Bonds: Når KCL opløses i vand, er de stærke elektrostatiske kræfter, der holder ionerne sammen i krystalgitteret, brudt.
* Dannelse af hydratiseringsskaller: På samme tid dannes nye interaktioner mellem ioner og vandmolekyler, hvilket danner hydratiseringsskaller.
* opløselighed: KCls evne til at opløses i vand afhænger af styrken af ion-dipolinteraktionerne sammenlignet med styrken af de ioniske bindinger i krystalgitteret.
Kortfattet: Kaliumchlorid opløses i vand, fordi ion-dipolinteraktionerne mellem ioner og vandmolekyler er stærke nok til at overvinde de ioniske bindinger, der holder krystalgitteret sammen. Dette fører til dannelse af hydratiseringsskaller, hvor vandmolekyler omgiver ionerne og stabiliserer dem i opløsning.
 Varme artikler
Varme artikler
-
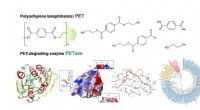 Strukturel indsigt i den molekylære mekanisme ved PET -nedbrydningStrukturel indsigt i den molekylære mekanisme ved poly (ethylenterephthalat) nedbrydning og det fylogenetiske træ af mulige PET -nedbrydende enzymer. Kredit:KAIST Et KAIST metabolisk ingeniørunder
Strukturel indsigt i den molekylære mekanisme ved PET -nedbrydningStrukturel indsigt i den molekylære mekanisme ved poly (ethylenterephthalat) nedbrydning og det fylogenetiske træ af mulige PET -nedbrydende enzymer. Kredit:KAIST Et KAIST metabolisk ingeniørunder -
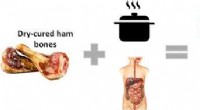 Tørrede skinkeknogler-en kilde til hjerte-sunde peptider?Kredit:ACS Drikkebenbouillon er en nylig diætfad, som fortalerne hævder bekæmper betændelse, letter ledsmerter og fremmer tarmsundhed. Simring af dyreknogler i vand frigiver kollagen og andre prot
Tørrede skinkeknogler-en kilde til hjerte-sunde peptider?Kredit:ACS Drikkebenbouillon er en nylig diætfad, som fortalerne hævder bekæmper betændelse, letter ledsmerter og fremmer tarmsundhed. Simring af dyreknogler i vand frigiver kollagen og andre prot -
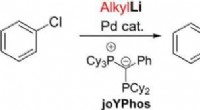 Direkte kobling af arylhalogenider og alkyllithiumforbindelser ved palladiumkatalyseKredit:Wiley Palladiumkatalysatorer hjælper med at syntetisere nøglekemikalier til mange industrier. Imidlertid, direkte reaktion af to grundlæggende reagenser, arylhalogenider og alkyllithiumforb
Direkte kobling af arylhalogenider og alkyllithiumforbindelser ved palladiumkatalyseKredit:Wiley Palladiumkatalysatorer hjælper med at syntetisere nøglekemikalier til mange industrier. Imidlertid, direkte reaktion af to grundlæggende reagenser, arylhalogenider og alkyllithiumforb -
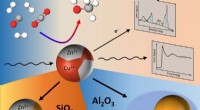 Zinkoxid:Nøglekomponent til methanolsyntesereaktionen over kobberkatalysatorerBimetalliske kobber-zink nanopartikler omdanner CO, CO2 og H2 til methanol. Kredit:© FHI/Kordus Den nuværende kommercielle produktion af methanol gennem hydrogenering af drivhusgassen CO 2 bygge
Zinkoxid:Nøglekomponent til methanolsyntesereaktionen over kobberkatalysatorerBimetalliske kobber-zink nanopartikler omdanner CO, CO2 og H2 til methanol. Kredit:© FHI/Kordus Den nuværende kommercielle produktion af methanol gennem hydrogenering af drivhusgassen CO 2 bygge


