Hvad er den tilfældige molekylære af et stof, der er størst Hvornår er det?
en gas ved høj temperatur.
Her er hvorfor:
* Gasser: Gasmolekyler er langt fra hinanden og har svage intermolekylære kræfter, så de kan bevæge sig frit og tilfældigt.
* Høj temperatur: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Højere temperaturer betyder højere kinetisk energi, hvilket fører til hurtigere og mere kraftig molekylær bevægelse.
Andre faktorer, der påvirker molekylær bevægelse:
* Matterilat: Faststoffer har den mindst tilfældige bevægelse, efterfulgt af væsker og derefter gasser.
* tryk: Forøget tryk i en gas kan reducere den gennemsnitlige afstand mellem molekyler lidt, hvilket kan reducere tilfældigheden af deres bevægelse.
Kortfattet: Kombinationen af en gasformig tilstand og høj temperatur maksimerer den tilfældige bevægelse af molekyler.
 Varme artikler
Varme artikler
-
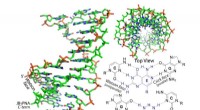 Syntetisk molekyle invaderer dobbeltstrenget DNAUdviklet af forskere ved Carnegie Mellon University, denne janus gamma peptid nukleinsyre (PNA) kan invadere den dobbelte helix af DNA og RNA. Kredit:Carnegie Mellon University Carnegie Mellon Uni
Syntetisk molekyle invaderer dobbeltstrenget DNAUdviklet af forskere ved Carnegie Mellon University, denne janus gamma peptid nukleinsyre (PNA) kan invadere den dobbelte helix af DNA og RNA. Kredit:Carnegie Mellon University Carnegie Mellon Uni -
 Strygning af technetiumforureningJerngranulat (til venstre) efter en måneds kontakt med technetium. Set under et scanningselektronmikroskop, de røde pletter (øverst til højre) indikerer, at technetium nu bevares af jernets nyligt dan
Strygning af technetiumforureningJerngranulat (til venstre) efter en måneds kontakt med technetium. Set under et scanningselektronmikroskop, de røde pletter (øverst til højre) indikerer, at technetium nu bevares af jernets nyligt dan -
 At bryde grænsen for kemiske forbindelserKredit:CC0 Public Domain Siden slutningen af det 19. århundrede, overgangsmetalcarbonyler har været en vigtig og velkendt klasse af forbindelser inden for koordinationskemi og organometallisk ke
At bryde grænsen for kemiske forbindelserKredit:CC0 Public Domain Siden slutningen af det 19. århundrede, overgangsmetalcarbonyler har været en vigtig og velkendt klasse af forbindelser inden for koordinationskemi og organometallisk ke -
 Livets kilde:Vanddråber rummer den hemmelige ingrediens til at opbygge livKredit:CC0 Public Domain Purdue University kemikere har afsløret en mekanisme til, at peptiddannende reaktioner kan forekomme i vand - noget, der har undret videnskabsmænd i årtier. Dette er i bun
Livets kilde:Vanddråber rummer den hemmelige ingrediens til at opbygge livKredit:CC0 Public Domain Purdue University kemikere har afsløret en mekanisme til, at peptiddannende reaktioner kan forekomme i vand - noget, der har undret videnskabsmænd i årtier. Dette er i bun
- Hver gang energi transformeres der altid en stigning i hvad?
- Levende celler kommer kun fra eksisterende kaldes?
- Er børnebørnene det værd? Klimaændringspolitik afhænger af, hvordan vi værdsætter den mennesk…
- Holder elektronik afkølet:Fund om modificeret form for grafen kan have indflydelse på styring af v…
- Hvor specifikt protein kan detekteres i western blot?
- Tre tusinde års kulilte-registreringer viser en positiv effekt global intervention i 1980'erne


