Hvor mange mol nitrogengas vil besætte en bind 347 ml ved 6680 Torr og 27 grader Celsius?
1. Konverter enheder
* bind: 347 ml =0,347 L (1 l =1000 ml)
* tryk: 6680 torr =8,82 atm (1 atm =760 torr)
* Temperatur: 27 ° C =300 K (k =° C + 273,15)
2. Ideel gaslov
Den ideelle gaslov er:
PV =NRT
Hvor:
* P =pres (i ATM)
* V =volumen (i L)
* n =antal mol
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (i k)
3. Løs for n
Omarranger den ideelle gaslov til at løse for 'n':
n =pv / rt
4. Tilslut værdier
n =(8,82 atm) (0,347 l) / (0,0821 L · atm / mol · K) (300 K)
5. Beregn
n ≈ 0,124 mol
Svar: Cirka 0,124 mol nitrogengas vil besætte dette volumen under disse forhold.
Sidste artikelBordsalt dannes, når et elektron overføres fra et natriumatom til et?
Næste artikelEr kobber mere reaktivt end brint?
 Varme artikler
Varme artikler
-
 Lyser på et obskurt proteomKredit:Unsplash/CC0 Public Domain Massespektrometri baseret proteomik er big-data videnskaben om proteiner, der tillader overvågning af overfloden af tusindvis af proteiner i en prøve på én gang.
Lyser på et obskurt proteomKredit:Unsplash/CC0 Public Domain Massespektrometri baseret proteomik er big-data videnskaben om proteiner, der tillader overvågning af overfloden af tusindvis af proteiner i en prøve på én gang. -
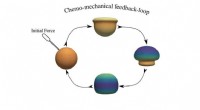 Design af bløde materialer, der efterligner biologiske funktionerKredit:Northwestern University Northwestern Engineering forskere har udviklet en teoretisk model til at designe bløde materialer, der demonstrerer autonome oscillerende egenskaber, der efterligner
Design af bløde materialer, der efterligner biologiske funktionerKredit:Northwestern University Northwestern Engineering forskere har udviklet en teoretisk model til at designe bløde materialer, der demonstrerer autonome oscillerende egenskaber, der efterligner -
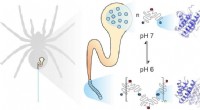 Dynamikken af silkeproteiner er nøglen til enestående stabilitet af edderkoppesilke som biomater…Edderkoppesilke er sammensat af individuelle proteiner. Mekaniske og kemiske faktorer påvirker, hvordan de samles. Underenhedernes dynamik spiller en vigtig rolle. Kredit:Benedikt Goretzki, Ute Hellmi
Dynamikken af silkeproteiner er nøglen til enestående stabilitet af edderkoppesilke som biomater…Edderkoppesilke er sammensat af individuelle proteiner. Mekaniske og kemiske faktorer påvirker, hvordan de samles. Underenhedernes dynamik spiller en vigtig rolle. Kredit:Benedikt Goretzki, Ute Hellmi -
 Mineral gennemgår selvhelbredelse af bestrålingsskaderTavleformet monazit på en xenotime krystal. Königsalm nær Senftenberg, Nedre Østrig. Kredit:Martin Slama Adskillige mineraler udsættes for radioaktiv selvbestråling og oplever langsigtede ændringe
Mineral gennemgår selvhelbredelse af bestrålingsskaderTavleformet monazit på en xenotime krystal. Königsalm nær Senftenberg, Nedre Østrig. Kredit:Martin Slama Adskillige mineraler udsættes for radioaktiv selvbestråling og oplever langsigtede ændringe
- Dissocierer kovalente bindinger i opløsning?
- Begyndelsen af den sidste istid
- Formidles en ionisk binding, når 2 atomer deler elektroner?
- Online dating vil sandsynligvis få et løft fra pandemi, siger sociolog
- Øger disse detailapps kundeengagement og salg i alle kanaler?
- Ny militærbeklædning afviser kemiske og biologiske agenser


