Hvad er forskellen mellem arrangement af elektroner i svovl og klor?
Elektronisk konfiguration:
* svovl (er): 1S² 2S² 2P⁶ 3S² 3P⁴
* klor (Cl): 1S² 2S² 2P⁶ 3S² 3P⁵
Nøgleforskelle:
* Antal valenselektroner: Svovl har 6 Valenselektroner (i 3'erne og 3p orbitaler), mens klor har 7 Valenselektroner.
* orbitalfyldning: Både svovl og klor har deres to første elektronskaller fyldt (1s og 2s). I den tredje skal har svovl imidlertid to elektroner i 3'erne orbital og fire elektroner i 3p -orbitaler, mens klor har to elektroner i 3'erne orbital og fem elektroner i 3p orbitaler.
orbitaldiagrammer:
Her er en forenklet repræsentation af elektronarrangementet i det yderste (valence) skal:
* svovl:
* 3S:↑ ↓
* 3p:↑ ↓ ↑ ↑
* klor:
* 3S:↑ ↓
* 3P:↑ ↓ ↑ ↓ ↑
implikationer:
* Kemisk reaktivitet: Forskellen i valenselektroner påvirker, hvor let svovl og klor danner kemiske bindinger. Klor, med en mindre elektron end en fuld oktet, har en tendens til at få et elektron for at opnå en stabil konfiguration, hvilket gør det til et stærkt oxidationsmiddel. Svovl, med to færre elektroner end en fuld oktet, er mindre reaktiv og kan få to elektroner eller dele elektroner til dannelse af bindinger.
* binding: Svovl kan danne kovalente bindinger med andre elementer ved at dele dens valenselektroner. Klor kan danne ioniske bindinger ved at få en elektron- eller kovalente bindinger ved at dele elektroner.
Kortfattet: Mens både svovl og klor er ikke -metaller i samme periode (række) af den periodiske tabel, fører deres elektronarrangement til forskellige kemiske egenskaber og reaktivitet.
 Varme artikler
Varme artikler
-
 Spejle kontrollerer kemisk selektivitetIndsprøjtning af reaktionsblandingen i det optiske hulrum ændrer hastigheden af den kemiske reaktion. Kredit:University of Strasbourg En kemisk reaktion omdanner de molekyler, der udgør stoffet.
Spejle kontrollerer kemisk selektivitetIndsprøjtning af reaktionsblandingen i det optiske hulrum ændrer hastigheden af den kemiske reaktion. Kredit:University of Strasbourg En kemisk reaktion omdanner de molekyler, der udgør stoffet. -
 Hvad får røget, forkullet grillmad til at smage så godt? Kemien ved at lave mad over åben ildDet er meget nemmere at kontrollere niveauet af forkulning på mad, når du laver mad på en grill. Kredit:Lablascovegmenu/Wikimedia Commons, CC BY Alene tanken om grillens røgfyldte dufte og berusend
Hvad får røget, forkullet grillmad til at smage så godt? Kemien ved at lave mad over åben ildDet er meget nemmere at kontrollere niveauet af forkulning på mad, når du laver mad på en grill. Kredit:Lablascovegmenu/Wikimedia Commons, CC BY Alene tanken om grillens røgfyldte dufte og berusend -
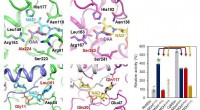 Forskere præsenterer en mikrobiel stamme, der er i stand til massiv ravsyreproduktionProteinudvikling af nøgleenzymer svarende til produktion af ravsyre. Kredit:KAIST Et forskerhold ledet af den fremtrædende professor Sang-Yup Lee rapporterede produktionen af en mikrobiel stamme
Forskere præsenterer en mikrobiel stamme, der er i stand til massiv ravsyreproduktionProteinudvikling af nøgleenzymer svarende til produktion af ravsyre. Kredit:KAIST Et forskerhold ledet af den fremtrædende professor Sang-Yup Lee rapporterede produktionen af en mikrobiel stamme -
 Det tosprogede molekyle forbinder to grundlæggende koder for livetDet nye molekyle rummer potentialet for forskellige biomedicinske anvendelser, siger Emory -kemiker Jennifer Heemstra (til højre), seniorforfatter af papiret. Hun vises i sit laboratorium med kandidat
Det tosprogede molekyle forbinder to grundlæggende koder for livetDet nye molekyle rummer potentialet for forskellige biomedicinske anvendelser, siger Emory -kemiker Jennifer Heemstra (til højre), seniorforfatter af papiret. Hun vises i sit laboratorium med kandidat
- Hvad er retningen af kraftgravet?
- Hvad modtager den luft, du lever i, sin varme fra?
- Microsoft følger Amazon i jagten på butikker uden kasserere
- Neutral elementarpartikel i atomkerner?
- Hacke planeten? Geoengineering forskning, etik, governance udforsket
- Undersøgelse viser potentiale for reduceret metan fra køer


