Lithium har en valenselektronbrom syv elektroner Hvordan kan de danne en kemisk binding?
* lithium ønsker at miste sin ene valenselektron for at opnå en stabil, fuld ydre skal som helium (2 elektroner). Dette gør det positivt ladet (+1).
* brom ønsker at få et elektron for at opnå en stabil, fuld ydre skal som Krypton (8 elektroner). Dette gør det negativt ladet (-1).
Resultatet:
Den stærke elektrostatiske tiltrækning mellem den positivt ladede lithiumion (Li+) og den negativt ladede bromidion (Br-) danner en ionisk binding . Dette resulterer i dannelsen af lithiumbromid (LiBr), en stabil ionisk forbindelse.
visuel repræsentation:
* lithium: [Han] 2S¹ -> [han] (mister elektron) -> li+
* brom: [AR] 4S² 3D¹⁰ 4P⁵-> [AR] 4S² 3D¹⁰ 4P⁶ (Gains Electron)-> Br-
I det væsentlige donerer Lithium sin elektron til brom og danner en stabil ionisk forbindelse med et forhold på 1:1.
Sidste artikelHvad er forskellen mellem arrangement af elektroner i svovl og klor?
Næste artikelHvad kaldes carbonhydrid med 3 carbonatomer?
 Varme artikler
Varme artikler
-
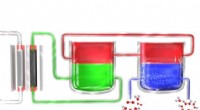 Ny proces kunne gøre brintoverilte tilgængelig på fjerntliggende stederI en ny metode til at producere hydrogenperoxid bærbart, en elektrolysator (til venstre) spalter vand til brint og ilt. Brintatomerne dannes oprindeligt i et elektrolytmateriale (grønt), som overfører
Ny proces kunne gøre brintoverilte tilgængelig på fjerntliggende stederI en ny metode til at producere hydrogenperoxid bærbart, en elektrolysator (til venstre) spalter vand til brint og ilt. Brintatomerne dannes oprindeligt i et elektrolytmateriale (grønt), som overfører -
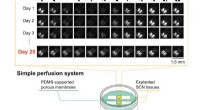 Hjernevæv holdt i live i ugevis på en kunstig membranNederst:mikroenhedsopsætningen med eksplanteret suprachiasmatic nucleus (SCN) væv. Øverst:rytmisk døgnaktivitet var stadig tydelig efter 25 dage, som angivet ved bioluminescensbilleddannelse. Kredit:R
Hjernevæv holdt i live i ugevis på en kunstig membranNederst:mikroenhedsopsætningen med eksplanteret suprachiasmatic nucleus (SCN) væv. Øverst:rytmisk døgnaktivitet var stadig tydelig efter 25 dage, som angivet ved bioluminescensbilleddannelse. Kredit:R -
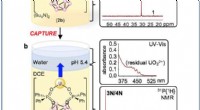 Team udvikler en elektrokemisk metode til udvinding af uran, og potentielt andre metalioner, fra lø…En illustration af den elektrokemiske koblingsmetode til at fange og frigive uranioner. Kredit:University of California - Santa Barbara For 50 år siden, videnskabsmænd ramte på, hvad de troede kun
Team udvikler en elektrokemisk metode til udvinding af uran, og potentielt andre metalioner, fra lø…En illustration af den elektrokemiske koblingsmetode til at fange og frigive uranioner. Kredit:University of California - Santa Barbara For 50 år siden, videnskabsmænd ramte på, hvad de troede kun -
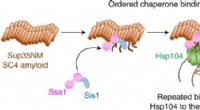 Tre ledsagere koordinerer opdelingen af amyloidfibriller i gærKredit:Yoshiko Nakagawa et al., Nature Chemical Biology (2022). DOI:10.1038/s41589-021-00951-y I et fund, der har vigtige konsekvenser for neurodegenerative lidelser såsom Alzheimers sygdom, har RI
Tre ledsagere koordinerer opdelingen af amyloidfibriller i gærKredit:Yoshiko Nakagawa et al., Nature Chemical Biology (2022). DOI:10.1038/s41589-021-00951-y I et fund, der har vigtige konsekvenser for neurodegenerative lidelser såsom Alzheimers sygdom, har RI
- Kan heliumatomer opdeles i to hydrogenatomer?
- To Voyagers lærte os, hvordan man lytter til rummet
- Hvad er højden på Ross Ice -hylde i Antarktis?
- Hvordan beregner du effektiviteten af noget i energitransformationer?
- Startup Diveplane ønsker at gøre AI etisk:CEO forklarer, hvad det betyder
- 1. maj:Hvordan elektricitet bragte strøm til strejker


