Kombineret natrium og nitrogen kombineret en molekylær forbindelse?
Her er hvorfor:
* natrium (NA) er et metal og har en tendens til at miste et elektron til at danne en positivt ladet ion (Na⁺).
* nitrogen (n) er en ikke -metal og har en tendens til at få tre elektroner til at danne en negativt ladet ion (n³⁻).
Når disse elementer reagerer, mister natrium sin elektron til nitrogen og danner en ionisk binding. Den resulterende forbindelse, natriumnitrid (Na₃n), består af et gitter af Na⁺ og N³⁻ -ioner, der holdes sammen af elektrostatiske kræfter.
Nøgleegenskaber for ioniske forbindelser:
* Dannet af den elektrostatiske tiltrækning mellem modsat ladede ioner.
* Typisk dannet mellem metaller og ikke -metaller.
* Høje smelte- og kogepunkter.
* Gode ledere af elektricitet i den smeltede tilstand eller når de blev opløst i vand.
molekylære forbindelser På den anden side dannes ved deling af elektroner mellem ikke -metalatomer. De har typisk lavere smelte- og kogepunkter end ioniske forbindelser og er normalt dårlige ledere af elektricitet.
Sidste artikelHvilken tilstand er Seaborgium ved stuetemperatur?
Næste artikelHvad er atomiciteten af fosfor?
 Varme artikler
Varme artikler
-
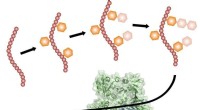 Hvordan patogene bakterier forbereder et klæbrigt adhæsionsproteinPatogene gram-positive bakterier, såsom S. gordonii , eksportere et serinrigt adhæsin for at lette deres binding til værtsceller. Adhesin bruger en dedikeret sekretionsvej, med flere trin, der forek
Hvordan patogene bakterier forbereder et klæbrigt adhæsionsproteinPatogene gram-positive bakterier, såsom S. gordonii , eksportere et serinrigt adhæsin for at lette deres binding til værtsceller. Adhesin bruger en dedikeret sekretionsvej, med flere trin, der forek -
 Svampeenzymer kan holde hemmeligheden bag fremstillingen af vedvarende energi fra træEn overordnet tredimensionel struktur af en af denne klasse af enzymer. Kredit:Professor Gideon Davies, University of York Et internationalt team af forskere, inklusive videnskabsmænd fra Univer
Svampeenzymer kan holde hemmeligheden bag fremstillingen af vedvarende energi fra træEn overordnet tredimensionel struktur af en af denne klasse af enzymer. Kredit:Professor Gideon Davies, University of York Et internationalt team af forskere, inklusive videnskabsmænd fra Univer -
 3D-billeddannelse af overfladekemi i indespærringForskere afbildede grænsefladekemien i den mikroskopisk afgrænsede geometri af en simpel mikrokapillær af glas. Kredit:@EPFL / Alain Herzog EPFL -forskere har udviklet et optisk billeddannelsesvær
3D-billeddannelse af overfladekemi i indespærringForskere afbildede grænsefladekemien i den mikroskopisk afgrænsede geometri af en simpel mikrokapillær af glas. Kredit:@EPFL / Alain Herzog EPFL -forskere har udviklet et optisk billeddannelsesvær -
 Eleven bruger planteaffald til at skabe et bæredygtigt alternativ til farvestofKredit:Imperial College London Kejserstuderende Nicole Stjernswärd bruger planteaffald til at skabe naturlige pulverpigmenter, der kan bruges til maling, blæk eller tekstiler. Historisk set kom f
Eleven bruger planteaffald til at skabe et bæredygtigt alternativ til farvestofKredit:Imperial College London Kejserstuderende Nicole Stjernswärd bruger planteaffald til at skabe naturlige pulverpigmenter, der kan bruges til maling, blæk eller tekstiler. Historisk set kom f
- Naturen hjælper mental sundhed, siger forskning - men kun for rige, hvide mennesker?
- Alt inde i cellen inklusive kerne?
- Sådan beregnes momentum efter en Collision
- Ungt stjernesystem fanget i færd med at danne tætte multipler
- Cohousing er en inkluderende tilgang til smart, bæredygtige byer
- Smeltes krydderier end salt i salt?


