Er fosfor svovlionisk eller kovalent?
* Elektronegativitet: Fosfor (P) og svovl (er) er begge ikke -metaller og har lignende elektronegativitetsværdier. Dette betyder, at de har et relativt lignende træk på delte elektroner. Forskellen i deres elektronegativitet er ikke stor nok til at skabe en komplet overførsel af elektroner, hvilket ville være karakteristisk for en ionisk binding.
* Deling af elektroner: I stedet for at det ene atom helt tager et elektron fra det andet, deler de elektroner for at opnå en stabil elektronkonfiguration. Denne deling danner en kovalent obligation.
Eksempler:
* fosforsulfid (P₂s₅): Denne forbindelse dannes af kovalente bindinger mellem fosfor og svovlatomer.
* Andre fosforsulfider: Der er forskellige fosforsulfider med forskellige forhold mellem fosfor og svovl, som alle dannes af kovalente bindinger.
Vigtig note: Mens bindingen mellem fosfor og svovl primært er kovalent, kan den udvise en vis grad af ionisk karakter på grund af den lille forskel i elektronegativitet. Dette betyder, at de delte elektroner ikke er perfekt jævnt fordelt, hvilket resulterer i en let polær kovalent binding.
Sidste artikelHvad er de 2 produkter dannet i en neutraliseringsreaktion?
Næste artikelHvem krediteres for at udvikle begrebet atomnumre?
 Varme artikler
Varme artikler
-
 Diagnostisk fremskridt:gasfølende kapsel skal på markedet i 2022Den elektroniske kapsel måler gasser i tarmen for at revolutionere diagnosen af tarmsygdomme. Kredit:Atmo Biosciences En elektronisk kapsel, der måler gasser i tarmen for at revolutionere diagno
Diagnostisk fremskridt:gasfølende kapsel skal på markedet i 2022Den elektroniske kapsel måler gasser i tarmen for at revolutionere diagnosen af tarmsygdomme. Kredit:Atmo Biosciences En elektronisk kapsel, der måler gasser i tarmen for at revolutionere diagno -
 Undersøgelse beskriver ny måde at generere insulinproducerende celler påKredit:CC0 Public Domain Forskere ved Karolinska Institutet i Sverige viser, hvordan et molekyle, som de har identificeret, stimulerer dannelsen af nye insulinproducerende celler i zebrafisk og p
Undersøgelse beskriver ny måde at generere insulinproducerende celler påKredit:CC0 Public Domain Forskere ved Karolinska Institutet i Sverige viser, hvordan et molekyle, som de har identificeret, stimulerer dannelsen af nye insulinproducerende celler i zebrafisk og p -
 Team løser et årti gammelt mysterium i kemiske transformationerPariserhjulet viser den katalytiske carboxylcyklus. Kredit:Cortland Johnson Forskere ved Pacific Northwest National Laboratory (PNNL) har løst et mysterium for en kemisk reaktion, der er afgørende
Team løser et årti gammelt mysterium i kemiske transformationerPariserhjulet viser den katalytiske carboxylcyklus. Kredit:Cortland Johnson Forskere ved Pacific Northwest National Laboratory (PNNL) har løst et mysterium for en kemisk reaktion, der er afgørende -
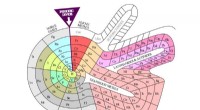 Det periodiske system er 150 - men det kunne have set meget anderledes udTheodor Benfeys spirabord (1964). Kredit:DePiep/Wikipedia Det periodiske system stirrer ned fra væggene i næsten alle kemilaboratorier. Æren for dens oprettelse går generelt til Dimitri Mendeleev,
Det periodiske system er 150 - men det kunne have set meget anderledes udTheodor Benfeys spirabord (1964). Kredit:DePiep/Wikipedia Det periodiske system stirrer ned fra væggene i næsten alle kemilaboratorier. Æren for dens oprettelse går generelt til Dimitri Mendeleev,
- Global opvarmning øger risikoen for frostskader på træer
- Hvad er en økoterapeut?
- Vurdering af hedebølgerisiko i byer, mens den globale opvarmning fortsætter
- Hvad er forskellen mellem olie og solenergi?
- Hvor er geotermisk energi tilgængelig?
- Hvad er to metoder, som geolog bruger til at bestemme en klippealder?


