Hvordan vil natrium og klor blive stabile?
* natrium (NA): Har en elektron i sin yderste skal. Den ønsker at miste dette elektron for at opnå en stabil oktet (8 elektroner) i sin ydre skal.
* klor (Cl): Har syv elektroner i sin yderste skal. Den ønsker at få et elektron for at opnå en stabil oktet.
Processen:
1. natrium (NA) Mister sin ene ydre elektron og bliver en positivt ladet ion kaldet natriumion (Na+) .
2. klor (CL) Få det elektron, som natrium mister, og bliver en negativt ladet ion kaldet chloridion (Cl-) .
3. modsatte afgifter tiltrækker. Den positivt ladede natriumion og den negativt ladede chloridion tiltrækkes af hinanden og danner en stærk elektrostatisk attraktion.
Resultatet:
* Den resulterende forbindelse, natriumchlorid (NaCl), er en stabil ionisk forbindelse med en neutral ladning. Octet -reglen er tilfreds med både natrium og klor, hvilket gør dem stabile.
Nøglepunkter:
* ioniske bindinger: Forekommer mellem metaller (som natrium) og ikke -metaller (som klor).
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration af otte elektroner i deres yderste skal.
* Elektrostatisk attraktion: Kraften, der holder de modsatte ladede ioner sammen i en ionisk binding.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse punkter!
 Varme artikler
Varme artikler
-
 Efter madlavning, bioberigede majs og æg bevarer de nødvendige næringsstoffer for at forhindre bl…Kredit:American Chemical Society Berigede og bioberigede fødevarer er på forkant med indsatsen for at bekæmpe A-vitaminmangel på verdensplan. Men lidt er kendt om, hvilken indflydelse forarbejdnin
Efter madlavning, bioberigede majs og æg bevarer de nødvendige næringsstoffer for at forhindre bl…Kredit:American Chemical Society Berigede og bioberigede fødevarer er på forkant med indsatsen for at bekæmpe A-vitaminmangel på verdensplan. Men lidt er kendt om, hvilken indflydelse forarbejdnin -
 Uventet ny dynamik for store DNA -molekyler i flydende suspensionKredit:CC0 Public Domain Polymerfysikere ved University of Massachusetts Amherst rapporterer i dag om den uventede og tidligere ukendte opførsel af et ladet makromolekyle, såsom DNA indlejret i en
Uventet ny dynamik for store DNA -molekyler i flydende suspensionKredit:CC0 Public Domain Polymerfysikere ved University of Massachusetts Amherst rapporterer i dag om den uventede og tidligere ukendte opførsel af et ladet makromolekyle, såsom DNA indlejret i en -
 Forskere forvandler ikke-giftige rester til belægning, der modstår slid, plet og sollysEn stol påført lignin. Kredit:Fotoni Film &Communications På grund af den globale indsats for at opfylde bæredygtighedsstandarder, mange lande søger i øjeblikket at erstatte beton med træ i bygnin
Forskere forvandler ikke-giftige rester til belægning, der modstår slid, plet og sollysEn stol påført lignin. Kredit:Fotoni Film &Communications På grund af den globale indsats for at opfylde bæredygtighedsstandarder, mange lande søger i øjeblikket at erstatte beton med træ i bygnin -
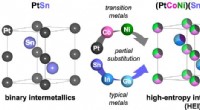 Carbonneutraliserende propylenproduktion katalyserer ændringer i petrokemisk teknikPlatin (Pt) og tin (Sn) steder i intermetallisk PtSn er delvist substitueret med henholdsvis Cobalt og nikkel (Co/Ni) og Indium og Gallium (In/Ga), hvilket danner en PtSn-type højentropi intermetallis
Carbonneutraliserende propylenproduktion katalyserer ændringer i petrokemisk teknikPlatin (Pt) og tin (Sn) steder i intermetallisk PtSn er delvist substitueret med henholdsvis Cobalt og nikkel (Co/Ni) og Indium og Gallium (In/Ga), hvilket danner en PtSn-type højentropi intermetallis
- Hvilken jordform, der er tydeligst forbundet med minedrift?
- Hvad fortæller en mudret flod dig om erosion?
- Videnskabsprojekter om hvilken gødning der dyrker en plante Faster
- Hvad bruges til at bære den genetiske kode fra DNA -ribosomer?
- Ny raffineringsteknik gør billigere superledere til en realitet
- Den første solformørkelsesfilm nogensinde bragt til live igen


