Hvad kræver det største volumen på 0,100 m natriumhydroxidopløsning til neutralisering?
* Syrens identitet: Forskellige syrer har forskellige antal sure protoner (H+ -ioner), der kan neutraliseres af NaOH.
* Koncentrationen af syren: En højere koncentration af syre kræver mere NaOH for neutralisering.
* syrevolumen: En større mængde syre kræver mere NaOH for neutralisering.
Her er hvordan man tænker over det:
* neutraliseringsreaktion: Reaktionen mellem en syre og en base (som NaOH) involverer reaktionen af H+ -ioner fra syren med OH-ioner fra basen til dannelse af vand.
* mol: For at neutralisere en syre fuldstændigt har du brug for et lige antal mol H+ -ioner og OH-ioner.
* volumen og koncentration: Antallet af mol af et stof beregnes ved at multiplicere dets koncentration (molaritet) med dets volumen (i liter).
Eksempel:
Lad os sige, at vi har to syrer, A og B:
* Syre A: 0,200 m HCI (saltsyre) - har en sur proton pr. Molekyle
* syre B: 0,100 m H2SO4 (svovlsyre) - har to sure protoner pr. Molekyle
For at neutralisere det samme volumen af hver syre, har vi brug for:
* Syre A: 1 mol NaOH pr. Mol HCl
* syre B: 2 mol NaOH pr. Mol H2SO4 (fordi det har to sure protoner)
Derfor ville en højere koncentration af syre eller en syre med mere sure protoner kræve et større volumen på 0,100 m NaOH til neutralisering.
For at give dig et endeligt svar skal du give følgende oplysninger:
* Identiteten af den eller de syrer, du sammenligner
* Koncentrationen af hver syre
* Mængden af hver syre (hvis relevant)
 Varme artikler
Varme artikler
-
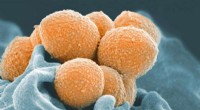 Sukker fra modermælk kan hjælpe med at behandle, forebygge infektioner hos nyfødteEt scanningselektronmikroskopbillede af gruppe A Streptococcus (orange) under fagocytisk interaktion med en human neutrofil (blå). Kredit:NIAID Bakterier kendt som gruppe B Streptococcus (GBS) er
Sukker fra modermælk kan hjælpe med at behandle, forebygge infektioner hos nyfødteEt scanningselektronmikroskopbillede af gruppe A Streptococcus (orange) under fagocytisk interaktion med en human neutrofil (blå). Kredit:NIAID Bakterier kendt som gruppe B Streptococcus (GBS) er -
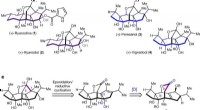 Kemikere syntetiserer perseanol for første gangen, Kemisk struktur, kulstofnummerering og ringsystembogstav tildeling for ryanodane (a) og isoryanodane (b) diterpener. c, Retrosyntetisk analyse af isoryanodane diterpen (+)-perseanol. [O], oxidatio
Kemikere syntetiserer perseanol for første gangen, Kemisk struktur, kulstofnummerering og ringsystembogstav tildeling for ryanodane (a) og isoryanodane (b) diterpener. c, Retrosyntetisk analyse af isoryanodane diterpen (+)-perseanol. [O], oxidatio -
 Livets kilde:Vanddråber rummer den hemmelige ingrediens til at opbygge livKredit:CC0 Public Domain Purdue University kemikere har afsløret en mekanisme til, at peptiddannende reaktioner kan forekomme i vand - noget, der har undret videnskabsmænd i årtier. Dette er i bun
Livets kilde:Vanddråber rummer den hemmelige ingrediens til at opbygge livKredit:CC0 Public Domain Purdue University kemikere har afsløret en mekanisme til, at peptiddannende reaktioner kan forekomme i vand - noget, der har undret videnskabsmænd i årtier. Dette er i bun -
 Termisk lagring til energiomstillingALMA-fordampningssystemet giver mulighed for at coate små dele. Kredit:Fraunhofer-Gesellschaft I Tyskland, 55 procent af det endelige energiforbrug går til opvarmning og køling. Imidlertid, meget
Termisk lagring til energiomstillingALMA-fordampningssystemet giver mulighed for at coate små dele. Kredit:Fraunhofer-Gesellschaft I Tyskland, 55 procent af det endelige energiforbrug går til opvarmning og køling. Imidlertid, meget
- Travl uge på den internationale rumstation
- Forsker undersøger nyt materiale dyrket af sukker
- Bevis på excitoniske isolatorer i moiré-supergitter
- Guld opsuger bor, spytter borophen ud
- Hvordan spillede videnskabelig observation en rolle i opdagelsen af vandklorering?
- Saudi-fonden lancerer ny gruppe for at styrke rumindustrien


