Hvad er et grundlæggende oxid?
Her er en sammenbrud:
Egenskaber:
* metaloxider: Grundlæggende oxider dannes, når et metal kombineres med ilt.
* reaktion med vand: Når et grundlæggende oxid reagerer med vand, danner det en base eller alkali. Denne reaktion er ofte eksoterm, hvilket betyder, at den frigiver varme.
* reaktion med syrer: Grundlæggende oxider reagerer med syrer for at danne salt og vand. Denne reaktion er en neutraliseringsreaktion.
Eksempler:
* natriumoxid (Na₂o): Na₂o + H₂O → 2NAOH (natriumhydroxid)
* calciumoxid (CAO): Cao + H₂O → CA (OH) ₂ (calciumhydroxid)
* magnesiumoxid (MGO): MGO + H₂O → MG (OH) ₂ (Magnesiumhydroxid)
Nøglepunkter:
* Den grundlæggende karakter af metaloxider øger generelt en gruppe i den periodiske tabel.
* Grundligheden af et metaloxid er relateret til elektronegativiteten af metallet. Metaller med lavere elektronegativitet danner mere basale oxider.
Ansøgninger:
* cement og mørtel: Calciumoxid (kalk) er en nøgleingrediens i cement og mørtel.
* ph -kontrol: Grundlæggende oxider bruges til at justere pH af opløsninger i forskellige industrielle processer.
* Kemisk syntese: Grundlæggende oxider er vigtige udgangsmaterialer i kemisk syntese.
Fortæl mig, hvis du har andre spørgsmål.
 Varme artikler
Varme artikler
-
 En ny gelelektroforese teknik til hurtig biomarkørdiagnose via massespektrometriOpløselige BAC-tværbundne geler muliggør hurtig og tabsfri genvinding af proteinbiomarkører adskilt af SDS-polyacrylamidgelelektroforese og letter analyse ved massespektrometri. Kredit: Journal of Pro
En ny gelelektroforese teknik til hurtig biomarkørdiagnose via massespektrometriOpløselige BAC-tværbundne geler muliggør hurtig og tabsfri genvinding af proteinbiomarkører adskilt af SDS-polyacrylamidgelelektroforese og letter analyse ved massespektrometri. Kredit: Journal of Pro -
 Forskere har opdaget nye forbindelser med herbicid potentiale fra havsvampOlesya Zhuravleva, Ph.D., Leder af Laboratoriet for biologisk aktive forbindelser, FEFU Naturvidenskabelige Skole. Kredit:FEFUs pressekontor Forskere ved Far Eastern Federal University (FEFU) og G
Forskere har opdaget nye forbindelser med herbicid potentiale fra havsvampOlesya Zhuravleva, Ph.D., Leder af Laboratoriet for biologisk aktive forbindelser, FEFU Naturvidenskabelige Skole. Kredit:FEFUs pressekontor Forskere ved Far Eastern Federal University (FEFU) og G -
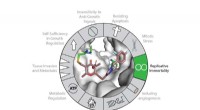 Kemikere hæmmer et kritisk gear til celleudødelighedTelomerase-ekspression bidrager til Kræftens kendetegn hovedsageligt gennem sin kanoniske rolle i telomervedligeholdelse og replikativ dødelighed. Telomerase (vist i gråt) kan hæmmes med en ny klasse
Kemikere hæmmer et kritisk gear til celleudødelighedTelomerase-ekspression bidrager til Kræftens kendetegn hovedsageligt gennem sin kanoniske rolle i telomervedligeholdelse og replikativ dødelighed. Telomerase (vist i gråt) kan hæmmes med en ny klasse -
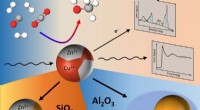 Zinkoxid:Nøglekomponent til methanolsyntesereaktionen over kobberkatalysatorerBimetalliske kobber-zink nanopartikler omdanner CO, CO2 og H2 til methanol. Kredit:© FHI/Kordus Den nuværende kommercielle produktion af methanol gennem hydrogenering af drivhusgassen CO 2 bygge
Zinkoxid:Nøglekomponent til methanolsyntesereaktionen over kobberkatalysatorerBimetalliske kobber-zink nanopartikler omdanner CO, CO2 og H2 til methanol. Kredit:© FHI/Kordus Den nuværende kommercielle produktion af methanol gennem hydrogenering af drivhusgassen CO 2 bygge
- Hvad er eksempler på uorganiske forbindelser?
- Ikke på helhedens vej? Du kan stadig se mandagens totale solformørkelse online
- Hvordan identificerer forskere typisk landformer?
- Facebook forsvarer datadeling efter ny rapport om partneraftaler
- Hvilke sekvenser viser korrekt energitransformationen fra indersiden af et batteri til tænder?
- Hvilken slags diagram viser, hvordan varmeenergi flyder, og det påvirker stenmaterialet?


