Hvad reagerer let med klor?
Metaller:
* alkalimetaller (gruppe 1): Reager voldsomt med klor for at danne metalchlorider. For eksempel reagerer natrium med klor for at danne natriumchlorid (bordsalt).
* alkaliske jordmetaller (gruppe 2): Reager kraftigt med klor for at danne metalchlorider. F.eks. Reagerer magnesium med klor for at danne magnesiumchlorid.
* Overgangsmetaller: Mange overgangsmetaller reagerer med klor for at danne metalchlorider. For eksempel reagerer jern med klor for at danne jern (III) chlorid.
ikke -metaller:
* brint: Reagerer med klor for at danne hydrogenchloridgas (HCI), en stærk syre.
* fosfor: Reagerer med klor til dannelse af fosforchlorider (PCL3 og PCL5).
* svovl: Reagerer med klor til dannelse af svovlchlorider (S2CL2 og SCL2).
Forbindelser:
* Vand: Reagerer med klor for at danne hypochlorosyre (HOCL) og saltsyre (HCI). Denne reaktion bruges i vandbehandling til at desinficere vand.
* kulbrinter: Reager med klor i en substitutionsreaktion på dannelse af klorerede carbonhydrider. Denne proces bruges til produktion af mange industrikemikalier.
Andre reaktioner:
* Oxidation: Klor kan fungere som et oxidationsmiddel og reagere med mange stoffer for at danne oxider. For eksempel kan klor oxidere jern til dannelse af jernoxid (RUST).
* halogenering: Klor kan reagere med andre halogener for at danne interhalogenforbindelser. For eksempel reagerer klor med brom til dannelse af brommonochlorid (BRCL).
Det er vigtigt at bemærke, at klorens reaktivitet kan variere afhængigt af de specifikke betingelser (temperatur, tryk, tilstedeværelse af katalysatorer osv.) Og den anden reaktant.
Fortæl mig venligst, hvis du har andre spørgsmål.
Sidste artikelHvilket molekyle indeholder carbonoxygen og nitrogen?
Næste artikelHvad er kogende og frysepunktet for kulstof?
 Varme artikler
Varme artikler
-
 Meget selektivt adsorberende materiale tiltrækker uønskede materialer til gavn for biofremstillingEZ Select demonstrerer superhydrofobe egenskaber ved at afvise en dråbe vand. Kredit:Mary Kelly og Claire Kohout, Argonne National Laboratory En skummende stout, et solidt brød, en skarp ost; hver
Meget selektivt adsorberende materiale tiltrækker uønskede materialer til gavn for biofremstillingEZ Select demonstrerer superhydrofobe egenskaber ved at afvise en dråbe vand. Kredit:Mary Kelly og Claire Kohout, Argonne National Laboratory En skummende stout, et solidt brød, en skarp ost; hver -
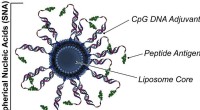 Vaccinedesign kan dramatisk forbedre kræftimmunoterapierDen mest succesfulde sfæriske nukleinsyre (SNA) i kræftimmunoterapivaccinen fik peptidantigenet spækket med DNA. Kredit:Shuya Wang/Northwestern University Når det kommer til effektiviteten af na
Vaccinedesign kan dramatisk forbedre kræftimmunoterapierDen mest succesfulde sfæriske nukleinsyre (SNA) i kræftimmunoterapivaccinen fik peptidantigenet spækket med DNA. Kredit:Shuya Wang/Northwestern University Når det kommer til effektiviteten af na -
 Når et porøst fast stof bevarer sine egenskaber i flydende formKrystallinsk struktur af ZIF-4-materialet ved stuetemperatur. Kredit:F.-X. Coudert / CNRS Kendt for deres enestående porøsitet, der muliggør indfangning eller transport af molekyler, metal-organis
Når et porøst fast stof bevarer sine egenskaber i flydende formKrystallinsk struktur af ZIF-4-materialet ved stuetemperatur. Kredit:F.-X. Coudert / CNRS Kendt for deres enestående porøsitet, der muliggør indfangning eller transport af molekyler, metal-organis -
 Team opdager dobbelt helixstruktur i syntetisk makromolekyleLou Madsen (tv.) er lektor i Kemisk Institut og har ledet et internationalt tværfagligt samarbejde om opdagelsen af den dobbelte helixstruktur af en polymer kaldet PBDT. Ying Wang (th.) er en tidlig
Team opdager dobbelt helixstruktur i syntetisk makromolekyleLou Madsen (tv.) er lektor i Kemisk Institut og har ledet et internationalt tværfagligt samarbejde om opdagelsen af den dobbelte helixstruktur af en polymer kaldet PBDT. Ying Wang (th.) er en tidlig
- Pas på, Mars:Her kommer vi med en flåde af rumfartøjer
- Hvad tiltrækker græshoppere?
- Katodestrålernes opførsel i et glasrør indeholdende gas ved lavtryksladte forskere til at konklud…
- Bedre sammen:Hvordan økosystemtjenester og adaptiv beslutningstagning kan forbedre arealforvaltning…
- Hvorfor har videnskabsmand forskellige synspunkter på klassificering af levende ting?
- Europas rumagentur forbereder sig på brexit-nedfald


