Hvad sker der med atomer fra de fleste ikke -metaller, når de reagerer med andre elementer?
Her er en sammenbrud:
* Elektronegativitet: Ikke -metaller har en stærk tiltrækning for elektroner på grund af deres relativt små atomradier og høje atomafgift.
* octet regel: Ikke -metaller har typisk brug for at få et par elektroner for at opnå en stabil elektronkonfiguration med en fuld ydre skal (ofte otte elektroner). Dette er kendt som Octet -reglen.
* Dannelse af anioner: Ved at vinde elektroner bliver ikke -metale atomer negativt ladede ioner kaldet anioner.
Eksempler:
* klor (Cl): Et kloratom får et elektron til at blive et chloridion (CL⁻).
* ilt (O): Et iltatom får to elektroner til at blive en oxidion (O²⁻).
Undtagelser:
* ædle gasser: Noble gasser har allerede en fuld ydre skal af elektroner, så de danner generelt ikke ioner eller reagerer let med andre elementer.
* brint: Hydrogen er et specielt tilfælde. Det kan få et elektron til at blive en hydridion (H⁻) eller miste et elektron for at blive en proton (H⁺).
Vigtig note: Mens de fleste ikke -metaller vinder elektroner, kan nogle også dele elektroner i kovalente bindinger, især når de reagerer med andre ikke -metaller.
Sidste artikelHvordan kan sølv- og kobberbinding til dannelse af Cuag?
Næste artikelFormel til fluordas plus natriumiodid?
 Varme artikler
Varme artikler
-
 Katalytiske protoceller bliver nervøseMørkefeltmikroskopibillede af en enkelt multi-kompartmental kapsel indeholdende tusindvis af katalytiske protoceller, der nedbryder hydrogenperoxid til vand og oxygengas. Kredit:Dr. Pierangelo Gobbo o
Katalytiske protoceller bliver nervøseMørkefeltmikroskopibillede af en enkelt multi-kompartmental kapsel indeholdende tusindvis af katalytiske protoceller, der nedbryder hydrogenperoxid til vand og oxygengas. Kredit:Dr. Pierangelo Gobbo o -
 Opdagelse kan føre til mere potent hvidløg, booster smag og dårlig åndeHannah Valentino, venstre, og Pablo Sobrado, ret, udfører forskning, der lægger grunden til en fremtid, hvor købere kan vælge hvidløg ud fra dets styrke og smagsprofil. Kredit:Virginia Tech I århu
Opdagelse kan føre til mere potent hvidløg, booster smag og dårlig åndeHannah Valentino, venstre, og Pablo Sobrado, ret, udfører forskning, der lægger grunden til en fremtid, hvor købere kan vælge hvidløg ud fra dets styrke og smagsprofil. Kredit:Virginia Tech I århu -
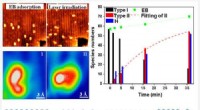 Forskere opdager CH-bindingsaktiveringsreaktioner ved lav temperatur ved foto-inducerede midlerHøjopløselig STM, der visualiserer reaktionens mellemtilstande og reaktionsvejen for EB-dehydrogenering på TiO2. Kredit:WANG Haochen CH-bindingen er meget vigtig i organisk kemi. Kemiske reaktione
Forskere opdager CH-bindingsaktiveringsreaktioner ved lav temperatur ved foto-inducerede midlerHøjopløselig STM, der visualiserer reaktionens mellemtilstande og reaktionsvejen for EB-dehydrogenering på TiO2. Kredit:WANG Haochen CH-bindingen er meget vigtig i organisk kemi. Kemiske reaktione -
 Forskere udvikler lovende ny type polymerLyse farver:SPPV -polymerer har mange vigtige teknologiske anvendelser. Kredit:TU Wien Organiske polymerer bruges i solceller, sensorer, LEDer og i mange andre enheder. En specifik type polymer, S
Forskere udvikler lovende ny type polymerLyse farver:SPPV -polymerer har mange vigtige teknologiske anvendelser. Kredit:TU Wien Organiske polymerer bruges i solceller, sensorer, LEDer og i mange andre enheder. En specifik type polymer, S


